
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
分析 A.Zn失电子作负极;
B.锌锰电池中电解质主要是NH4Cl,碱性锌锰电池中的电解质为强碱;
C.锌锰电池的负极锌筒易被NH4Cl溶液腐蚀;
D.干电池属于一次电池.
解答 解:A.Zn失电子作负极,所以锌锰电池和碱性锌锰电池的负极材料均是锌,故A错误;
B.锌锰电池中电解质主要是NH4Cl,碱性锌锰电池中的电解质是用强碱代替了氯化铵,一般碱性锌锰电池中的电解质主要是KOH,故B正确;
C.锌锰电池的负极为锌筒,NH4Cl溶液水解显酸性,所以锌易被NH4Cl溶液腐蚀,因此碱性锌锰电池比锌锰电池的寿命长,故C错误;
D.干电池属于一次电池,一次电池不能反复充放电,故D错误.
故选B.
点评 本题考查了常见的化学电源,题目难度不大,注意把握锌锰电池和碱性锌锰电池的差别以及一次电源、二次电源.


科目:高中化学 来源: 题型:选择题
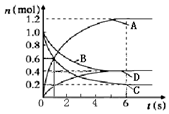 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )| A. | 该反应的化学方程式为3B+4C=6A+2D | |
| B. | 反应进行到1s时,3v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的质量分数不变 | |
| D. | 反应进行到6s时,B的平均反应速率为0.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
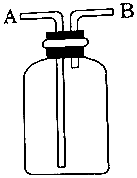
| A. | A瓶中盛满水,从B口进气,用排水法收集O2 | |
| B. | 瓶中盛适量浓硫酸,从A口进气来干燥Cl2 | |
| C. | 从B口进气,用排空气法收集Cl2 | |
| D. | 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的大约体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定会有CO32- | |
| B. | 某溶液中滴加了Na2CO3溶液,生成白色沉淀,该溶液中一定会有Ba2+ | |
| C. | 某无色溶液滴加酚酞试液显红色,该溶液不一定是碱液 | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下,反应的平衡常数是$\frac{1}{64}$ | |
| B. | 0~2min内,HI的平均反应速率为0.1mol•L-1•min-1 | |
| C. | 在恒容条件下,向该体系中充入HI气体,平衡不移动,反应速率不变 | |
| D. | 升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com