
 +CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$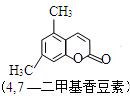

分析 (1)根据装置图分析:a为三个颈的烧瓶,为三颈烧瓶;
(2)根据实验的需要结合大气压强原理来回答,装置b中将活塞上下部分连通,能平衡上下气压,使漏斗中液体顺利流下;
(3)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(4)反应需要搅拌12h,使反应物充分接触反应,提高反应产率;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
(6)实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯;为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,据此分离混合物.
解答 解:(1)由装置图分析可知a为三颈烧瓶,b为恒压滴液漏斗,
故答案为:三颈烧瓶;
(2)装置中装置b中将活塞上下部分连通具有平衡气压的作用,使漏斗中间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物顺利流下,
故答案为:平衡上下气压,使漏斗中液体顺利流下;
(3)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓硫酸将有机物氧化和炭化;
(4)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,
故答案为:使反应物充分接触反应,提高反应产率;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL(0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算理论产量为0.21mol×174g/mol=36.54g,则产率为$\frac{33.0g}{36.54g}$×100%≈90.3%,
故答案为:90.3%;
(6)实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯,反应方程式为CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,用分液漏斗分离,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;碳酸钠溶液;分液漏斗.
点评 本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫(SO2) | B. | 二氧化碳(CO2) | C. | 二氧化氮(NO2) | D. | 总悬浮颗粒物(TSP) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 反应的化学方程式是
反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  加成反应 加成反应 | |
| C. |  消去反应 消去反应 | |
| D. |  加聚反应 加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com