
【题目】已知短周期元素的离子![]() A2+、
A2+、![]() B+、
B+、![]() C2-、
C2-、![]() D- 都具有相同的电子层结构,则下列叙述中正确的是
D- 都具有相同的电子层结构,则下列叙述中正确的是
A.原子序数d > c > b > aB.离子半径:C2- > D- > B+ > A2+
C.单质的还原性:A > BD.非金属性:D < C
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法正确的是( )
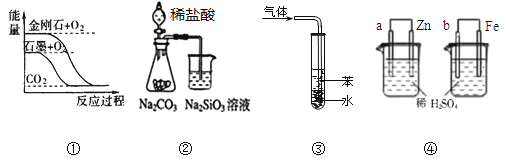
A.图①表示石墨转变为金刚石是吸热反应
B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅
C.图③吸收NH3并防倒吸
D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2 L密闭容器中充入2 mol N2和10 mol H2发生反应N2+3H2![]() 2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
A. v(N2)=3 v(H2)B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=0.5mol·L-1·min-1D. 再充入2 mol N2化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)在量取浓盐酸时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:(将操作补充完整)
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,____________________________________________。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)若用1mol/L HCl溶液润洗容量瓶,再转移溶液,所配置的溶液浓度将_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有c(CH3COOH)+c(CH3COO-)= 0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是( )
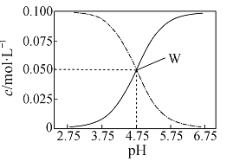
A.pH=5. 5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH =3.5的溶液中:c(CH3COOH) + c(CH3COO-)= c(Na+)
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
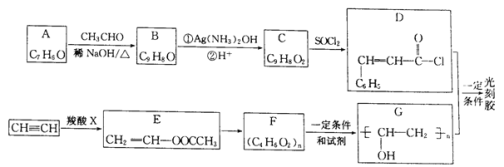
已知; 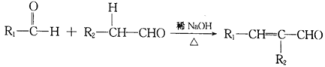 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
(1)A的名称为________;羧酸X的结构简式为___________________。
(2)C可与乙醇发生酯化反应,其化学方程式为____________,反应中乙醇分子所断裂的化学键是____________(填选项字母)。
aC——C键 b.C——H键 c.O——H键 d.C——O键
(3)E→F的化学方程式为___________;F到G的反应类型为_______________。
(4)写出满足下列条件B的2种同分异构体:___________、____________________。
①分子中含有苯环;②能发生银镜反应;③核磁共振氢谱峰面积比为2:2:2:1:1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用):___________________________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用序号回答:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥P4 ⑦NH3· H2O ⑧Na2O2 ⑨HClO ⑩CaO HF MgCl2。
(1)只存在离子键的是____________________
(2)属于共价化合物的是____________________
(3)既存在离子健又存在共价键的是____________________
Ⅱ.同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区别这些概念吗?下面列出了几组物质,请将物质的合适组号填写在下表中。
①![]() 和
和![]() ; ②CH3C(CH3)2CH3和
; ②CH3C(CH3)2CH3和![]() ;
;
③CH4和CH3CH2CH3; ④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
组号 | ________ | ___________ | ________ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含Ce[ CO3]F)为原料制备CeO2的一种工艺流程如图所示:
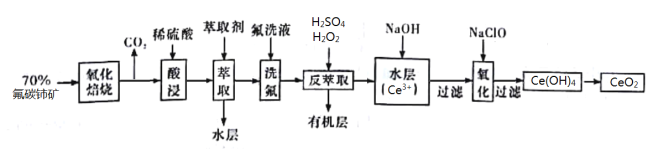
已知:①Ce4+能与F![]() 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能;
③Ksp[Ce(OH)3]=1×10-20。
回答下列问题:
(1)Ce[CO3]F中铈元素的化合价为___________,H2O2分子的结构式为____________________。
(2)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是____________________________________。
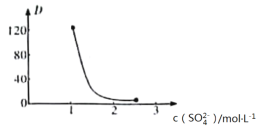
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
(4)“反萃取”中,实验室用到的主要玻璃仪器名称为___________;在H2SO4,和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有2molH2O2参加反应,转移电子的物质的量为_____________。为使Ce3+完全沉淀,应加入NaOH调节pH为_________。(溶液中c(Ce3+)小于1.0×10-5molL-1时,可认为Ce3+沉淀完全)
(5)“氧化”步骤的化学方程式为_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com