
| A. | 分别加入碘水,观察颜色反应 | |
| B. | 分别加稀硫酸煮沸,再加足量NaOH溶液调至碱性,加银氨溶液加热观察有无银镜 | |
| C. | 分别加热水溶解,观察溶解性 | |
| D. | 放在嘴里咀嚼,有无甜味产生 |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
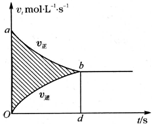 过程中以B的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示为( )
过程中以B的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示为( )| A. | c(B)减少 | B. | n(B)减少 | C. | c(B)增加 | D. | n(B)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杀死水果周围的细菌,防止水果霉变 | |
| B. | 吸收水果周围的氧气,防止水果腐烂 | |
| C. | 吸收水果产生的乙烯,防止水果早熟 | |
| D. | 氧化性较强,催熟水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解产物在应用中都只能作为氧化剂 | |
| B. | 电解一段时间后,溶液pH不变 | |
| C. | 阳极反应:3H2O-6e-═O3+6H+ | |
| D. | 每生成1 mol O3转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

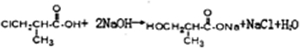 ;高分子化合物H的结构简式为
;高分子化合物H的结构简式为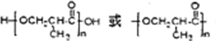 .
.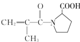 ,F有多种同分异构体,如
,F有多种同分异构体,如 等.写出满足下列条件的F的同分异构体的结构简式:
等.写出满足下列条件的F的同分异构体的结构简式: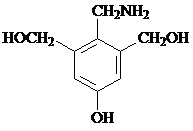 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
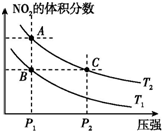
| A. | 两种不同的温度比较:T1>T2 | |
| B. | A、C两点的反应速率:A>C | |
| C. | B、C两点的气体的平均相对分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热的方法实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
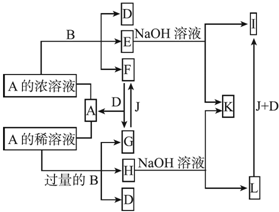
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:ClO-、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、NH${\;}_{4}^{+}$ | |
| B. | pH=2的溶液中:Fe2+、Na+、Mg2+、NO${\;}_{3}^{-}$ | |
| C. | 能使KSCN溶液变红的溶液中:Na+、I-、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | |
| D. | 由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com