
【题目】1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a = 2,b = 1 B. a=39,b =2 C. a=2,b = 2 D. a=3,b = 3
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用小苏打(NaHCO3)发酵面团制作馒头
B. 用Al(OH)3治疗胃酸过多
C. 干燥的氯气和液氯均能使干燥的有色布条褪色
D. 光导纤维的主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是_________。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化 d.单位时间内反应物转移4 mol 电子,同时消耗2 mol SO3 e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①升高温度,该反应的平衡常数__________(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=________,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为________(填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ______点,温度T1 ___T2(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g) 2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③恒容充入CO2 ④恒容下充入N2 ⑤ 恒压下充入N2。能够使反应速率增大的措施是( )
A. ①④B. ②③⑤C. ①③D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)亚铜离子(Cu+)基态时电子排布式为_______________。,其电子占据的原子轨道数目为___________个。
(2)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______________(填标号a,b,c)。

(3)单晶硅可由二氧化硅制得,二氧化硅晶体结构如上图所示,在二氧化硅晶体中,Si、 O原子所连接的最小环为十二元环,则每个Si原子连接 _________个十二元环。
(4)氮化镓(GaN)的晶体结构如右图所示。常压下,该晶体熔 点1700℃,故其晶体类型为_______;判断该晶体结构中存在配位键的依据是________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-。[B(OH)4]-中B原子的杂化轨道类型为________________;不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为_______________________;
(6)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如右图所示,该物质的化学式为________。已知该晶 体密度为ρg.cm-3,晶胞边长为a pm。则锗的相对原子质量为_____________(用含ρ和a的关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在有机物的分子中引入羟基官能团的反应类型有:(a)酯化反应,(b)取代反应,(c)消去反应,(d)加成反应,(e)水解反应。其中正确的组合有
A.(a)(b)(c) B.(d)(e)
C.(b)(d)(e) D.(b)(c)(d)(e)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是____,所加40%NaOH不宜过量太多的原因是____。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,该反应的离子方程式为____。
(3)使用下列用品来测定溶液的pH,合理的是____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
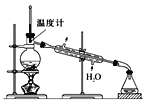
①该装置中存在的错误是____。
②在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:____。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com