
【题目】常温下,用0.1mol/L的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示。![]() ,下列分析不正确的是
,下列分析不正确的是
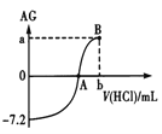
A. ROH为弱碱
B. 若a=8,从A到B的过程中,水的电离程度逐渐减小
C. A点溶液c ( Cl-)=c (R+)
D. 若b=15,溶液中存在![]() c(Cl-)+c(ROH)+c(OH-)=c(H+)
c(Cl-)+c(ROH)+c(OH-)=c(H+)
【答案】B
【解析】A.依据0.1mol/LROH的AG值计算判断;
B.依据水电离影响因素判断:酸、碱抑制水的电离,能水解的盐促进水的电离;
C.A点溶液呈中性,依据电荷守恒判断;
D.b=15,溶液中存在RCl两份,HCl一份,依据溶液中存在的物料、电荷守恒判断。
A.依据图象可知:0.1mol/LROH的AG为-7.2,则:c(H+)/c(OH-)=10-7.2,结合c(H+)·c(OH-)=10-14得c(OH-)=10-3.4mol/L,小于0.1mol/L,所以ROH为弱碱,A正确;
B.RCl为强酸弱碱盐,A点溶液为中性,但没有达到恰好完全反应的点前,水的电离程度是越来越大,恰好反应后加入酸,抑制水的电离,水的电离程度减小,B错误;
C.依据溶液中电荷守恒原则:c(Cl-)+c(OH-)=c(R+)+c(H+),A点溶液呈中性,氢氧根离子浓度等于氢离子浓度,则c(Cl-)=c(R+),C正确;
D.b=15,溶液中存在RCl两份,HCl一份,依据溶液中存在的电荷守恒:c(Cl-)+c(OH-)=c(R+)+c(H+),物料守恒:3[c(R+)+c(ROH)]=2c(Cl-),得:![]() c(Cl-)+c(ROH)+c(OH-)=c(H+),D正确;答案选B。
c(Cl-)+c(ROH)+c(OH-)=c(H+),D正确;答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A.Al(OH)3受热能分解
B.Al2O3既能溶于强酸溶液又能溶于强碱溶液
C.Al(OH)3胶体能吸附水中的悬浮物
D.Al(OH)3能溶于过量的浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、H+、CO32-B.Fe2+、SO42-、OH-
C.Na+、Cl-、Ag+D.K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种元素的性质或原子结构的相关叙述如表所示。
元素 | 元素性质或原子结构的相关叙述 |
T | 失去1个电子后,形成与Ne相同的核外电子排布 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
回答下列问题:
(1)元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是________。
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是________。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________(写化学式)。
(4)画出T原子的结构示意图:____________。
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。

溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | ________ |
②AlCl3溶液 | 通过量NH3 | ________ |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | ________ |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是化工行业广泛应用的基础原料,某化学兴趣小组为探究浓硫酸所具有的一些特殊性质,进行如下有关实验。
实验一:浓硫酸与铜反应
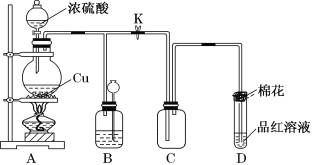
(1)装置A中发生反应的化学方程式为_____________________________;当反应转移0.2mol电子时,生成气体在标况下的体积为_________L。
(2)装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是______________;
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是________________,B中应放置的溶液是________。
A 水 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
实验二:浓硫酸与碳反应,并验证反应生成的气体产物
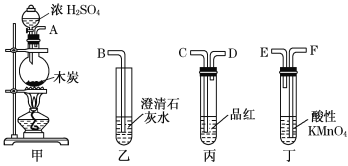
(4)冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A——________________________________________——B;能说明气体产物中有CO2的实验现象是①__________________②____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com