
| A. | Na2S2中硫元素的化合价为-2 | B. | NH4Cl的电子式: | ||
| C. | S2-的结构示意图: | D. | COCl2的电子式: |
分析 A.根据在化合物中正负化合价代数和为零,结合Na2S2的化学式进行解答;
B.氯化铵的电子式中氯离子的最外层电子式没有标出;
C.S2-的最外层电子数为8,核外电子总数为18;
D.光气(COCl2)中含有两个碳氯键和1个碳氧双键.
解答 解:A.钠元素显+1,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x×2=0,则x=-1,故A错误;
B.NH4Cl为离子化合物,阴阳离子需要标出所带电荷,铵根离子和氯离子还应该标出最外层电子,氯化铵正确的电子式为: ,故B错误;
,故B错误;
C.S2-的结构示意图中,最外层电子数为8,硫离子正确的结构示意图为: ,故C错误;
,故C错误;
D.光气(COCl2)分子中含有1个碳氧双键、2个碳氯键,其结构式为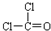 ,电子式为
,电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了元素的化合价、电子式、离子结构示意图等判断,题目难度中等,注意明确常见的化学用语的概念及正确表示方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 用玻璃棒搅拌漏斗中的液体可以加快过滤的速度 | |
| B. | 用澄清的石灰水可鉴别CO2和SO2 | |
| C. | 某元素从化合态变为游离态时,该元素可能被氧化也可能被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、OH-、K+ | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
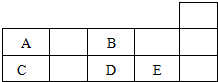
| A. | 对应阴离子的还原性:E>D | B. | 原子半径:C>B | ||
| C. | 对应氧化物的水化物的酸性:E>D | D. | A的非金属性弱于D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①铝片发生的电极反应式是:Al+4OH--3e═AlO2-+2H2O | |
| B. | 图②b电极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| C. | 图③溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3 | |
| D. | 图④充电时:阳极反应是PbSO4+2H2O-2e-═PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
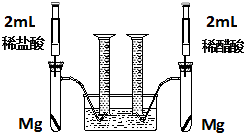 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com