
下列溶液中,离子一定能大量共存的是
A.pH=1的溶液中:K+、CH3COO-、SO42-、Na+
B.含有0.1mol/LCa2+的溶液中:Na+、SO42-、K+、Cl-
C.含有0.1mol/LMg2+的溶液中:Na+、SO42-、K+、HCO3-
D.滴入酚酞显红色的溶液:K+、HCO3-、Ba2+、Cl-
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷(解析版) 题型:实验题
下图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出上述仪器的名称:A___________,C________________,E________。
(2)分离以下混合物应该主要选用上述什么仪器(填字母)
①粗盐和泥沙:___________;②花生油和水:____________。
(3)关于仪器的使用,下列说法不正确的是________。
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打 开上边的塞子
开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
(4)若向C装置中加 入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?______________。
入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?______________。
(5)下列是进行该操作的步骤,正确的顺序是___________。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接收溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高一上期中化学卷(解析版) 题型:选择题
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;
X2++Z===X+Z2+;Y+Z2+===Y2++Z。这四种离子的氧化性强弱顺序正确的是
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:实验题
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、托盘天平,还缺少 (填仪器名称)
(2)应称量胆矾晶体的质量 。
(3)下列操作会使所配溶液浓度偏低的是 。
①胆矾失去了部分结晶水②容量瓶未干燥就使用③称量晶体时所用的砝码已经生锈④定容时俯视刻度线⑤定容摇匀后发现液面低于刻度线,又加水至刻度线
(4)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(5)若实验室想要将密度为1.84 g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2 mol/L、密度为1.20 g/cm3的稀硫酸,则所需浓硫酸的体积 ,所需水的体积 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:选择题
质量分数不同的两种硫酸溶液,以相同质量混合时,所得混合溶液的密度为ρ1;以相同体积混合时,所得混合溶液的密度为ρ2,两种浓度不同的乙醇(密度小于水)溶液,以相同质量混合时,所得混合溶液的密度为ρ3;以相同体积混合时,所得溶液 密度为ρ4 ,则ρ1、ρ2、ρ3、ρ4大小之间关系为
密度为ρ4 ,则ρ1、ρ2、ρ3、ρ4大小之间关系为
A.ρ1>ρ2>ρ3 >ρ4 B.ρ1>ρ2>ρ4 >ρ3
C.ρ2>ρ1>ρ3>ρ4 D.ρ2>ρ1>ρ4 >ρ3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上期中化学卷(解析版) 题型:选择题
下列条件下,两瓶气体所含的原子数不一定相等的是
A.同质量、不同密度的C2H4和C3H6 B.同质量、不同体积 的CO和N2
的CO和N2
C.同体积、同密度的N2O和CO2 D.同压强、同体积的CO2和SO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高二上期中化学卷(解析版) 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g)  SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3 )加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。

(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高二上期中化学卷(解析版) 题型:选择题
下列事实不能用平衡移动原理解释的是( )
A. 工业合成氨时选择500℃
B. 配制FeCl3溶液时加入少量的盐酸
C. 在Na2CO3溶液中,由水电离出的c(OH﹣)>1×10﹣7mol/L
D. AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中必修化学卷(解析版) 题型:选择题
钚(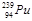 )是制造威力更大原子弹的良好原料。下列有关说法错误的是
)是制造威力更大原子弹的良好原料。下列有关说法错误的是
A. 原子序数为94 B. 质子数为94 C. 质量数为239 D. 中子数为94
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com