
| A. | 0 | B. | 32g | C. | 38.4g | D. | 48g |
分析 Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子守恒得到硝酸铜的物质的量,再根据离子方程式计算加入稀硫酸后溶解的Cu.
解答 解:Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成NO3-得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=$\frac{\frac{22.4L}{22.4L/mol}×4}{2}$=0.2mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.2mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×10mol/L×0.1L=2mol,n(H+):n(NO3- )=2mol:0.4mol=5:1>$\frac{1}{4}$,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,
设溶解Cu的质量为x,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.4mol
192g:2mol=x:0.4mol
x=$\frac{192g}{2mol}×0.4mol$=38.4g,
故选C.
点评 本题考查氧化还原反应有关计算,为高频考点,明确物质之间反应实质是解本题关键,注意过量计算,注意转移电子守恒的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑧ | B. | ①②③⑤ | C. | ②③④⑥ | D. | ②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将10.6g Na2CO3溶于100mL水中 | |
| B. | 将57.2g Na2CO3•10H2O溶于少量水中,再用水稀释至200mL | |
| C. | 将20 mL 5.0mol/L Na2CO3溶液用水稀释至100mL | |
| D. | 将21.2gNa2CO3•10H2O溶于200mL水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
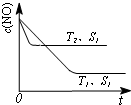 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: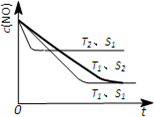 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2NA | |
| B. | 每生成0.15 molH2,被还原的水分子数目为0.3NA | |
| C. | 当加入2.7gAl时,转移的电子数目为0.3NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com