
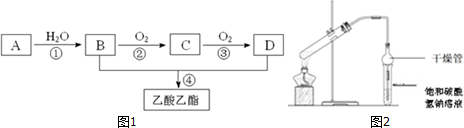
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为H2C=CH2,A和水反应生成B,B能连续被氧化,且B和D反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH,
(1)A是乙烯、D是乙酸,乙酸中官能团为-COOH;
(2)乙醇被催化氧化生成乙醛;
(3)①有缓冲的装置能防止倒吸;
②n(CH3CH2OH )=$\frac{18.4g}{46g/mol}$=0.4mol,n(CH3COOH)=$\frac{12.0g}{60g/mol}$=0.2mol,乙酸和乙醇的酯化反应方程式为
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O,根据方程式知,0.4mol乙醇完全反应需要0.4mol乙酸,实际上乙酸不足量,所以以乙酸为标准进行计算,如果乙酸完全反应,则生成乙酸乙酯的质量=0.2mol×88g/mol=17.6g,其产率=$\frac{实际质量}{理论质量}$×100%.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为H2C=CH2,A和水反应生成B,B能连续被氧化,且B和D反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH,
(1)A是H2C=CH2、D是乙酸,乙酸中官能团为-COOH,名称是羧基,
故答案为:H2C=CH2;羧基;
(2)乙醇被催化氧化生成乙醛,方程式为2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2H2O;
(3)①有缓冲的装置能防止倒吸,干燥管有缓冲作用,能防止倒吸,故答案为:防倒吸;
②n(CH3CH2OH )=$\frac{18.4g}{46g/mol}$=0.4mol,n(CH3COOH)=$\frac{12.0g}{60g/mol}$=0.2mol,乙酸和乙醇的酯化反应方程式为
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O,根据方程式知,0.4mol乙醇完全反应需要0.4mol乙酸,实际上乙酸不足量,所以以乙酸为标准进行计算,如果乙酸完全反应,则生成乙酸乙酯的质量=0.2mol×88g/mol=17.6g,其产率=$\frac{实际质量}{理论质量}$×100%=$\frac{10.6g}{17.6g}$×100%=60.2%,
故答案为:60.2%.
点评 本题考查有机物推断、物质制备等知识点,为高频考点,侧重考查学生分析判断及实验操作、计算能力,明确物质之间转化、物质性质及实验原理是解本题关键,注意(3)要进行过量计算,为易错点.


科目:高中化学 来源: 题型:解答题
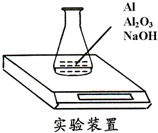 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>A>B>D | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请完成下列各题
请完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
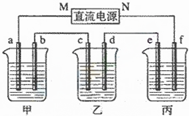 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
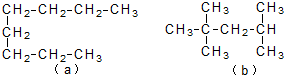
| A. | a和b都不能使酸性KMnO4溶液褪色 | |
| B. | a和b分子中的所有碳碳单键间的键角都相同 | |
| C. | a的沸点比b高 | |
| D. | b脱氢可以形成3种单烯烃分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验氨气 | |
| B. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| C. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| D. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com