
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为280(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请回答下列问题。
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是 ,原因是 。
(3)目前常用阴、阳离子交换树脂来进行硬水的软化,如水中的Ca2+、Mg2+可与交换树脂中的 交换。当阴离子交换树脂失效后可放入 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指 (填A或B);
②写出通电后阳极区的电极反应式: 。
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
I.请仔细观察下列两种电池的构造示意图,完成下列问题:
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题:
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极 ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为______________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为: ,随着放电的进行,溶液的pH (填“变大”“变小”或“不变”)。
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以_______为阳极电解 溶液,阳极电极反应式为 。
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
(1)打开K2,闭合K1,B为_______极,A的电极反应为_____,最终可观察到的现象是 。
(2)打开K1,闭合K2,E为_______极,检验F极产生气体的方法是 。该装置中发生反应的化学方程式为_________。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时, 极周围能变红(填A、B、E、或F)。
(4)若电源选用燃料电池,结构如下图,以熔融碳酸盐为电解质(非水溶济,能够传导CO32-),电池工作时电解质组成保持稳定,通入甲烷的电极为________极,请写出正极反应的方程式 ,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为 mol(假设燃料电池能量转化率为75%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为细菌冶铜和火法冶铜的主要流程。
(1) 硫酸铜溶液一般呈________(填“酸”、“碱”或“中”)性,原因是________ (用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:______________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为________________(写出一点即可)。
(3) 用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?________(填“正确”或“不正确"),原因是__________
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:
CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是________(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量________固体于试管中,加入________使其溶解,再加入________溶液,观察现象。
④已知电解前,U形管中加入了________100mL0.5 mol . L-1 CuCl2溶液,电解结朿时电路中一共转移了 0.03 mol电子,且阴极生成0. 64 g铜,则形成的低价阳离子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不合理的是( )
| A.除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B.检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸。水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 |
| C.除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D.鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【选修2化学与技术】(15分)
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: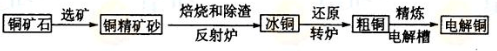
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、
,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。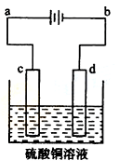
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com