

分析 电镀废渣(除镍外,还含有铜、锌、铁等元素),加入稀硫酸过滤得到含有镍离子、铜离子、锌离子、亚铁离子的滤液,后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,据此分析解答.
解答 解:(1)在待镀件上镀镍,待镀件作阴极,镀层金属镍做阳极,电解质溶液用镍离子的盐溶液,阴极析出的镍与阳极溶解的镍等量,故电解质溶液的浓度不变;
故答案为:阴;不变;
(2)向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24,当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10-5mol/L,则溶液中的c(S2-)=$\frac{Ksp(ZnS)}{c(Z{n}^{2+})}$=$\frac{1.6×1{0}^{-24}}{1{0}^{-5}}mol/L$=1.6×10-19mol/L,则c(Cu2+)=$\frac{Ksp(CuS)}{c({S}^{2-})}$=$\frac{1.3×1{0}^{-36}}{1.6×1{0}^{-19}}$mol/L≈8.1×10-18 mol/L;
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);8.1×10-18;
(3)对滤液Ⅱ先加过氧化氢,可氧化Fe2+生成Fe3+,调节pH有利于水解生成氢氧化铁沉淀而除去;
故答案为:除去 Fe3+;
(4)滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶((或富集NiSO4);
(5)26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,解得x=6;
故答案为:6.
点评 本题为综合题,考查了溶解平衡、溶度积的有关计算盐类的水解、物质的分离提纯以及原电池知识,侧重于学生的分析能力和实验能力的考查,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:填空题
 ;
;
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | 在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C | |
| C. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
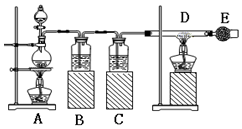 已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:
已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ HCO3- NO3- ClO- | B. | Na+ SO32- NH4+ Ba2+ | ||
| C. | Ba2+ S2- Cl- SO42- | D. | AlO2- CO32- Cl- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 | |
| B. | 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应 | |
| C. | 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 | |
| D. | 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com