
(1)混合气体中CH4和O2的物质的量之比为多少?
(2)若某条件下水为气态,气体的摩尔体积为50 L·mol-1,在该条件下点燃混合气体,混合气恰好完全燃烧,共生成CO2 13.2 g,求原混合气体中氧气的物质的量和生成的混合气体在该条件下的密度。
解析:(1)CH4、HCHO、O2三种气体的相对分子质量分别为16、30、32,而混合气的平均相对分子质量即为C2H6的相对分子质量30。正巧与HCHO的相对分子质量相同。故CH4和O2组成气体的平均相对分子质量必须为30,用十字交叉法求出其物质的量比。
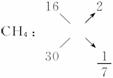
O2: 32 14
即n(CH4)∶n(O2)=1∶ 7
(2)n(CO2)=![]() =0.3 mol
=0.3 mol
设原有CH4 x mol,则n(HCHO)=(0.3-x) mol,n(O2)=7x mol
CH4完全燃烧时:CH4—2O2
x 2x
HCHO完全燃烧时:HCHO —O2
0.3-x 0.3-x
2x+0.3-x=7x x=0.05 (mol)
n(O2)=7x=0.35 mol
又CH4、HCHO燃烧前后Δn=0(H2O为气态),反应前后平均分子量不变。
又因为![]() =30, 而
=30, 而![]() =50·ρ
=50·ρ
所以ρ=![]() =0.6 g·L-1
=0.6 g·L-1
答案:(1)混合气中n(CH4)∶n(O2)=1∶7,
(2)原混合气中含O2 0.35 mol。


科目:高中化学 来源: 题型:
今有CH4、HCHO、O2三种成分的混合气体,同温同压下与乙烷气体的密度相同。问:
(1)混合气体中CH4和O2的物质的量之比为多少?
(2)若某条件下水为气态,气体的摩尔体积为50 L·mol-1,在该条件下点燃混合气体,混合气恰好完全燃烧,共生成CO2 13.2 g,求原混合气体中氧气的物质的量和生成的混合气体在该条件下的密度。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有CH4、HCHO、O2三种成分的混合气体,同温同压下与乙烷气体的密度相同。问:
(1)混合气体中CH4和O2的物质的量之比为多少?
(2)若某条件下水为气态,气体的摩尔体积为50L/mol,在该条件下点燃混合气体,混合气恰好完全燃烧,共生成CO2 13.2g,求原混合气体中氧气的物质的量和生成的混合气体在该条件下的密度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com