
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下,7.8g苯中含有单键的数目为0.9NA
B. 标准状况下,14g氮气含有的核外电子数为5NA
C. 标准状况下,2.24LH2与02的混合物中含有的分子数为0.1NA
D. 常温下,lL0.1mol·L-1的NH4N03溶液中氧原子数为0.3NA
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
物质 | 试剂 | 分离方法 | |
A | 硝酸钾固体(氯化钠) | 蒸馏水 | 重结晶 |
B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
D | 甲烷(乙烯) | 硫酸 | 洗气 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3溶液中滴加酚酞呈红色,原因是____________________(用离子方程式表示)。加热后颜色变________(填“深”或“浅”),0.1mol/L Na2CO3溶液和,0.1mol/L NaHCO3溶液比较,水的电离程度前者________后者(填“>”“等于”或“<”)。
![]()
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素的碱性溶液制备氢气,尿素的结构简式为:(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题:

①右池是____________池;
②电极b是_______极,其电极反应式为__________________。
③通电2min后,Al电极质量减轻2.7g,则产生N2的体积为__________(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。回答下列问题:
(1)二氧化硫的制备
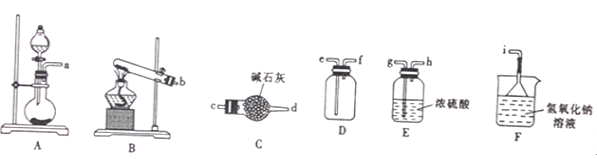
①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→ ____________。(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。
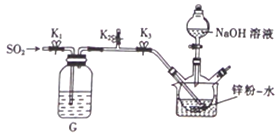
①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0 .10 mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
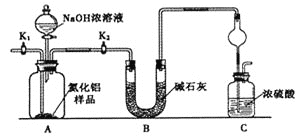
(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:
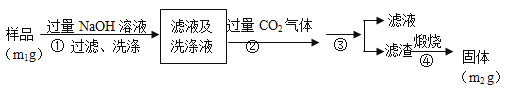
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略)。

已知:有关物质的性质如下表:

请回答下列问题:
(1)仪器A的名称是_____________,仪器A中盛装的试剂是_____________。
(2)CCl4的电子式为________________。
(3)装置C处硬质玻管中反应的化学方程式为_________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为_______________。
(5)仪器N中收集到的物质主要有_____(写化学式),从产物中分离出TiCl4的实验方法是________________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为_______。请设计实验方案验证产物气体中有CO:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是最常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼。 | 第3周期元素的简单离子中半径最小。 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子。 |
(1)写出元素T的离子结构示意图______________;写出元素X的气态氢化物的电子式__________;写出Z元素原子的外围电子排布式__________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Y元素原子的第一电离能______镁(填“>”“<”“=”),从结构上分析,其理由是:__________________。
(3)元素T与氟元素相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是_______(填序号字母)。
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组离子能大量共存的是 ( )
A. Cu2+ 、K+、Cl-、NO3- B. Ag+、Na+、NO3-、Cl-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com