
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A、PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A错误;
B、次氯酸中,H原子的最外层满足2个电子,故B错误;
C、氯化硫(S2Cl2)结构式是Cl-S-S-Cl,S原子的原子核外最外层电子数为6,每个S原子形成2个共价键,所以满足最外层8电子结构;Cl原子的原子核外最外层电子数为7,其在分子中的化合价为-1价,所以满足最外层8电子结构,故C正确;
D、白磷P4的结构式为 ,P原子最外层电子数是5,每个P原子形成3个共价键,所以白磷中P原子满足8电子结构,故D正确.
,P原子最外层电子数是5,每个P原子形成3个共价键,所以白磷中P原子满足8电子结构,故D正确.
故选CD.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 苯和乙醇均不能使酸性高锰酸钾溶液褪色 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质、纤维素、蔗糖、淀粉都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
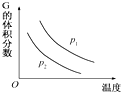 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )| A. | 正反应为放热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而减小 | D. | 增大压强,容器内气体的质量变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com