
(10·Ö)»ÆѧÓėČĖĄąÉē»įæɳ֊ų·¢Õ¹ĆÜĒŠĻą¹Ų£¬ÄÜŌ“”¢»·¾³”¢²ÄĮĻŅŌ¼°ČÕ³£Éś»īµČ¶¼Ąė²»æŖ»Æѧ”£
(1)¹čŹĒĪŽ»ś·Ē½šŹō²ÄĮĻµÄÖ÷½Ē”£ĒėÄć¾Ł³öĮ½ÖÖŗ¬¹čµÄ²ÄĮĻĆū³Ę ”ų £»ĀĮÖĘĘ·ŅņĪŖ±ķĆęŅ׊Ī³ÉÖĀĆܵÄŃõ»ÆĀĮ±”Ĥ¶ų¾¾ĆÄĶÓĆ£¬µ«ŹĒøĆŃõ»ÆĤŅ×±»Ėį¼īĘĘ»µ£¬Čō½«Ńõ»ÆĀĮÓėĒāŃõ»ÆÄĘČÜŅŗ×÷ÓĆ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”ų ”£
(2)ĀČĘųÓĆÓŚĘÆ°×”¢Ļū¶¾Ź±£¬ÄÜĘšĘÆ°×”¢Ļū¶¾×÷ÓƵÄĪļÖŹŹĒ ”ų (Š“»ÆѧŹ½)”£Č±ĢśŠŌʶŃŖ»¼ÕßÓ¦²¹³äFe2£«£¬Ķس£ŅŌĮņĖįŃĒĢśµÄŠĪŹ½£¬¶ųĮņĖįĢśŌņƻӊÕāÖÖŅ©Š§”£µ±ÓĆĮņĖįŃĒĢśÖĘ³ÉŅ©Ę¬Ź±Ķā±ķ°üÓŠŅ»²ćĢŲŹāµÄĢĒŅĀ£¬Õā²ćĢĒŅĀµÄ×÷ÓĆŹĒ ”ų ”£
(3)ĖįÓźÓŠŗÜ“óĪ£ŗ¦£¬ÓŠŃ§ÕßĢį³öĄūÓĆ Fe 2Ź®”¢Fe3Ź®µČĄė×ӵē߻Æ×÷ÓĆ£¬³£ĪĀĻĀ½«SO2Ńõ»Æ³ÉSO42Ņ»¶ųŹµĻÖSO2µÄ»ŲŹÕĄūÓĆ”£ĪŖ¼ģŃé»ŲŹÕѳʷ֊ŹĒ·ńÓŠSO![]() Éś³É£¬Ä³Ķ¬Ń§Éč¼ĘĮĖČēĻĀŹµŃé·½°ø£ŗ
Éś³É£¬Ä³Ķ¬Ń§Éč¼ĘĮĖČēĻĀŹµŃé·½°ø£ŗ
 |
ÉĻŹö·½°øŹĒ·ńŗĻĄķ?“š ”ų £¬ÄćµÄĄķÓÉŹĒ ”ų ”£
 Źī¼ŁĻĪ½Ó½Ģ²ÄĘŚÄ©Źī¼ŁŌ¤Ļ°Īäŗŗ³ö°ęÉēĻµĮŠ“š°ø
Źī¼ŁĻĪ½Ó½Ģ²ÄĘŚÄ©Źī¼ŁŌ¤Ļ°Īäŗŗ³ö°ęÉēĻµĮŠ“š°ø ¼ŁĘŚ×÷ŅµŹī¼Ł³É³¤ĄÖŌ°ŠĀ½®ĒąÉŁÄź³ö°ęÉēĻµĮŠ“š°ø
¼ŁĘŚ×÷ŅµŹī¼Ł³É³¤ĄÖŌ°ŠĀ½®ĒąÉŁÄź³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
£Ø10 ·Ö£©SO2ŗĶNOxµÄÅÅ·ÅŹĒŌģ³ÉĖįÓźµÄĮ½“ó×ļæż»öŹ×”£ĻĀĶ¼±ķŹ¾ĮĖijµŲĒųŌŚ1940~2002Äź¼ä£¬æÕĘųÖŠSO2ŗĶNOxŗ¬ĮæŅņČ¼ĮĻČ¼ÉÕ”¢¹¤ŅµÉś²ś”¢½»ĶØŌĖŹäŅŌ¼°ĘäĖūŅņĖŲµÄÓ°Ļģ¶ų·¢Éś±ä»ÆµÄ»ł±¾Ķ³¼ĘŹż¾Ż”£

£Ø1£©½įŗĻÉĻĶ¼Źż¾Ż£¬ÅŠ¶ĻĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”ų ”£
A£®ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄNOxÓėČ¼ĮĻµÄ²»³ä·ÖČ¼ÉÕÓŠ¹Ų
B£®ŌŚÉĻŹĄ¼Ķ60Äź“śŅŌĒ°£¬ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄSO2Ö÷ŅŖŹĒŹ¹ÓĆČ¼ĆŗµÄÄŚČ¼»śĖłÖĀ
C£®½üÄźĄ“ŌŚ¹¤ŅµÉś²śÖŠSO2ÅÅ·ÅĮæµÄĻĀ½µ£¬Ö÷ŅŖŹĒ¼õÉŁĮĖČ¼ÉÕµÄĆŗµÄÖŹĮæ
D£®Ėę×ÅĘū³µ¹¤ŅµµÄ·¢Õ¹£¬ŌŚŠĪ³ÉĖįÓźµÄŅņĖŲÖŠ£¬NOxĖłÕ¼±ČÖŲŌŚÖš½„Ōö“ó
£Ø2£©ŌŚÉĻĶ¼±ķŹ¾µÄĄśŹ·½ų³ĢÖŠ£¬Óɹ¤ŅµÉś²śĖłµ¼ÖĀµÄSO2µÄÅÅ·ÅĮæĆ÷ĻŌµŲŌŚÖšÄź¼õÉŁ”£ĒėÓĆ»Æѧ·½³ĢŹ½ĖµĆ÷ČĖĄąŌŚĪŖ½ā¾öSO2ĪŪČ¾ĪŹĢāÖŠĖł½ųŠŠµÄŅ»øö·“Ó¦¹ż³Ģ£ŗ
”ų ”£
£Ø3£©Ęū³µÅŷŵÄĪ²ĘųÖŠŗ¬ÓŠĪ“Č¼ÉÕ³ä·ÖµÄCmHn”¢ŅŌ¼°N2”¢CO2”¢NO”¢COµČ”£ÓŠČĖÉč¼ĘĄūÓĆ·“Ó¦2NO + 2CO ![]() N2 + 2CO2 ½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£
N2 + 2CO2 ½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£
ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
| Ź±¼ä/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol”¤L-1 | 1.00”Į10-3 | 4.5”Į10-4 | 2.5”Į10-4 | 1.5”Į10-4 | 1.00”Į10-4 | 1.00”Į10-4 |
| c(CO)/mol”¤L-1 | 3.6”Į10-3 | 3.05”Į10-3 | 2.85”Į10-3 | 2.75”Į10-3 | 2.70”Į10-3 | 2.70”Į10-3 |
![]()
![]()
![]()
![]() ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ
ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ![]() ”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£
”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£![]() ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£
ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£
£Ø4£©Ä³“Ī½µÓź¹ż³ĢŹÕ¼Æµ½10LµÄÓźĖ®£¬ĻņÓźĖ®ÖŠµĪ¼Ó1mL6mol/LµÄH2O2£¬³ä·Ö·“Ó¦ŗó²āµĆČÜŅŗµÄpH=3.62 [c(H+) =2.4”Į10-4 mol/L ]£©£¬ŌŁĻņČÜŅŗÖŠ¼ÓČė×ćĮæµÄBa(OH)2ČÜŅŗ£¬¾¹żĀĖ”¢ĮĄøÉ”¢³ĘÖŲ£¬µĆ³ĮµķµÄÖŹĮæĪŖ0.1864g”£Čō¼ŁÉčÓźĖ®µÄĖįŠŌ½öÓÉNOxŗĶSO2µÄÅÅ·ÅĖłÖĀ”£Ēė¼ĘĖćÅÅ·ÅŌŚæÕĘųÖŠµÄNOxŗĶSO2µÄĪļÖŹµÄĮæÖ®±Č½Ó½üÓŚ ”ų ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ½ĖÕŹ”ÄĻĶØŹŠĶØÖŻĒų2010½ģøßČż²éĀ©²¹Č±×ØĻīĮ·Ļ°»ÆѧŹŌĢā ĢāŠĶ£ŗĢīæÕĢā
£Ø10 ·Ö£©SO2ŗĶNOxµÄÅÅ·ÅŹĒŌģ³ÉĖįÓźµÄĮ½“ó×ļæż»öŹ×”£ĻĀĶ¼±ķŹ¾ĮĖijµŲĒųŌŚ1940~2002Äź¼ä£¬æÕĘųÖŠSO2ŗĶNOxŗ¬ĮæŅņČ¼ĮĻČ¼ÉÕ”¢¹¤ŅµÉś²ś”¢½»ĶØŌĖŹäŅŌ¼°ĘäĖūŅņĖŲµÄÓ°Ļģ¶ų·¢Éś±ä»ÆµÄ»ł±¾Ķ³¼ĘŹż¾Ż”£
£Ø1£©½įŗĻÉĻĶ¼Źż¾Ż£¬ÅŠ¶ĻĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”ų ”£
| A£®ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄNOxÓėČ¼ĮĻµÄ²»³ä·ÖČ¼ÉÕÓŠ¹Ų |
| B£®ŌŚÉĻŹĄ¼Ķ60Äź“śŅŌĒ°£¬ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄSO2Ö÷ŅŖŹĒŹ¹ÓĆČ¼ĆŗµÄÄŚČ¼»śĖłÖĀ |
| C£®½üÄźĄ“ŌŚ¹¤ŅµÉś²śÖŠSO2ÅÅ·ÅĮæµÄĻĀ½µ£¬Ö÷ŅŖŹĒ¼õÉŁĮĖČ¼ÉÕµÄĆŗµÄÖŹĮæ |
| D£®Ėę×ÅĘū³µ¹¤ŅµµÄ·¢Õ¹£¬ŌŚŠĪ³ÉĖįÓźµÄŅņĖŲÖŠ£¬NOxĖłÕ¼±ČÖŲŌŚÖš½„Ōö“ó |
 N2 + 2CO2½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£
N2 + 2CO2½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£| Ź±¼ä/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol”¤L-1 | 1.00”Į10-3 | 4.5”Į10-4 | 2.5”Į10-4 | 1.5”Į10-4 | 1.00”Į10-4 | 1.00”Į10-4 |
| c(CO)/mol”¤L-1 | 3.6”Į10-3 | 3.05”Į10-3 | 2.85”Į10-3 | 2.75”Į10-3 | 2.70”Į10-3 | 2.70”Į10-3 |



 ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ
ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ ”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£
”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£ ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£
ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğŗÓÄĻŹ”Ö£ÖŻŹŠøßČżµŚČż“Ī²āŃéŌ¤²āĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĶŹĒŅ»ÖÖÓėČĖĄą¹ŲĻµ·Ē³£ĆÜĒŠµÄÓŠÉ«½šŹō”£³£ĪĀĻĀ£¬Cu2+ŌŚČÜŅŗÖŠĪČ¶Ø£¬ Cu+ŌŚĖįŠŌĢõ¼žĻĀŅ×·¢ÉśĘē»Æ·“Ó¦£ŗ2Cu+=Cu2++Cu£»“󶹏ż +1¼ŪĶµÄ»ÆŗĻĪļŹĒÄŃČÜ Īļ£¬Čē£ŗCu20”¢Cul”¢CuCl”¢CuH µČ”£
£Ø1£©ŌŚCuCl2ČÜŅŗÖŠÖšµĪ¼ÓČė¹żĮæKIČÜŅŗ£¬æÉÄÜ·¢ÉśµÄ·“Ó¦ÓŠ£ŗ
2Cu2++4I-=2CuI”ż£Ø°×É«£©+I2; 2Cu2++4I-+2Cl-=CuCl”ż£Ø°×É«£©+I2
ŅŃÖŖ£ŗ³£ĪĀĻĀKsp(CuCl)=1.20”Į10-6(mol/L)2; Ksp(CuI)=5.06”Į10-12(mol/L)2”£ ÓÉ“ĖĶʶĻÉĻŹö·“Ӧɜ³ÉÖ÷ŅŖ³ĮµķĪļµÄ»ÆѧŹ½ŹĒ______”£
£Ø2£©ĻņCuHÖŠ¼ÓČė¹żĮæĻ”HC1£¬ÓŠĘųĢåÉś³É£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______”£
£Ø3£©½« ±ł Ķ£ØÓÉCu2SŗĶFeSČŪŗĻ³Éŗ¬Cu 18%”Ŗ20%µÄŅ»ÖÖĪļÖŹ£©¼ÓČėČŪ¼Į£¬ŌŚó{ĪĀĻĀ “µČėæÕĘų£¬±łĶÖŠµÄCu2S±»Ńõ»ÆĪŖCu2O£¬Éś ³É µÄCu2OÓėCu2S·“Ӧɜ³É“ÖĶ”£ÉĻŹöĮ½øö·“Ó¦µÄ»Æѧ·½³ĢŹ½·Ö±šŹĒ______”¢______”£
£Ø4£©³£ĪĀĻĀ£¬Ļņ0.20 mol • L-1ĮņĖįĶČÜŅŗÖŠ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ£¬Éś³ÉĒ³Ą¶É«ĒāŃõ»ÆĶ ³Įµķ£¬µ±ČÜŅŗµÄpH = 6Ź±£¬c(Cu2+)=______mol.L‑1”£[ŅŃÖŖ£ŗKsp(CuI)=2.2”Į10-20(mol/L)3]
£Ø5£©½«0.80 gCuSO4 • 5H2Oѳʷ¼ÓČČ·Ö½ā£¬ĘäĶŃĖ®¹ż³ĢÖŠ¹ĢĢåÖŹĮæĖęĪĀ¶ČµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
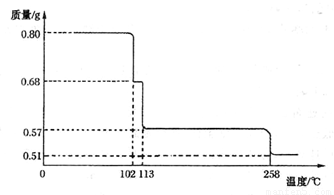
Ēė Č·¶Ø110”ćCŹ±¹ĢĢåĪļÖŹµÄ»ÆѧŹ½____________”££ØŅŖĒ󊓳öĶʶĻ¹ż³Ģ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ½ĖÕŹ”ÄĻĶØŹŠĶØÖŻĒų2010½ģøßČż²éĀ©²¹Č±×ØĻīĮ·Ļ°»ÆѧŹŌĢā ĢāŠĶ£ŗĢīæÕĢā
£Ø10 ·Ö£©SO2ŗĶNOxµÄÅÅ·ÅŹĒŌģ³ÉĖįÓźµÄĮ½“ó×ļæż»öŹ×”£ĻĀĶ¼±ķŹ¾ĮĖijµŲĒųŌŚ1940~2002Äź¼ä£¬æÕĘųÖŠSO2ŗĶNOxŗ¬ĮæŅņČ¼ĮĻČ¼ÉÕ”¢¹¤ŅµÉś²ś”¢½»ĶØŌĖŹäŅŌ¼°ĘäĖūŅņĖŲµÄÓ°Ļģ¶ų·¢Éś±ä»ÆµÄ»ł±¾Ķ³¼ĘŹż¾Ż”£

£Ø1£©½įŗĻÉĻĶ¼Źż¾Ż£¬ÅŠ¶ĻĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”ų ”£
A£®ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄNOxÓėČ¼ĮĻµÄ²»³ä·ÖČ¼ÉÕÓŠ¹Ų
B£®ŌŚÉĻŹĄ¼Ķ60Äź“śŅŌĒ°£¬ŌŚ½»ĶØŌĖŹäÖŠÅŷŵÄSO2Ö÷ŅŖŹĒŹ¹ÓĆČ¼ĆŗµÄÄŚČ¼»śĖłÖĀ
C£®½üÄźĄ“ŌŚ¹¤ŅµÉś²śÖŠSO2ÅÅ·ÅĮæµÄĻĀ½µ£¬Ö÷ŅŖŹĒ¼õÉŁĮĖČ¼ÉÕµÄĆŗµÄÖŹĮæ
D£®Ėę×ÅĘū³µ¹¤ŅµµÄ·¢Õ¹£¬ŌŚŠĪ³ÉĖįÓźµÄŅņĖŲÖŠ£¬NOxĖłÕ¼±ČÖŲŌŚÖš½„Ōö“ó
£Ø2£©ŌŚÉĻĶ¼±ķŹ¾µÄĄśŹ·½ų³ĢÖŠ£¬Óɹ¤ŅµÉś²śĖłµ¼ÖĀµÄSO2µÄÅÅ·ÅĮæĆ÷ĻŌµŲŌŚÖšÄź¼õÉŁ”£ĒėÓĆ»Æѧ·½³ĢŹ½ĖµĆ÷ČĖĄąŌŚĪŖ½ā¾öSO2ĪŪČ¾ĪŹĢāÖŠĖł½ųŠŠµÄŅ»øö·“Ó¦¹ż³Ģ£ŗ
”ų ”£
£Ø3£©Ęū³µÅŷŵÄĪ²ĘųÖŠŗ¬ÓŠĪ“Č¼ÉÕ³ä·ÖµÄCmHn”¢ŅŌ¼°N2”¢CO2”¢NO”¢COµČ”£ÓŠČĖÉč¼ĘĄūÓĆ·“Ó¦2NO + 2CO  N2 + 2CO2 ½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£
N2 + 2CO2 ½«ÓŠŗ¦µÄĪŪČ¾Īļ×Ŗ»ÆĪŖæɲĪÓė“óĘųŃ»·µÄN2ŗĶCO2”£
ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
|
Ź±¼ä/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol”¤L-1 |
1.00”Į10-3 |
4.5”Į10-4 |
2.5”Į10-4 |
1.5”Į10-4 |
1.00”Į10-4 |
1.00”Į10-4 |
|
c(CO)/mol”¤L-1 |
3.6”Į10-3 |
3.05”Į10-3 |
2.85”Į10-3 |
2.75”Į10-3 |
2.70”Į10-3 |
2.70”Į10-3 |

 ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ
ŌŚÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ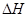 ”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£
”ų 0£Ø”°>”±”¢”°<”±”¢”°=”±£©”£ ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£
ŌŚøĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżK= ”ų ”£
£Ø4£©Ä³“Ī½µÓź¹ż³ĢŹÕ¼Æµ½10LµÄÓźĖ®£¬ĻņÓźĖ®ÖŠµĪ¼Ó1mL6mol/LµÄH2O2£¬³ä·Ö·“Ó¦ŗó²āµĆČÜŅŗµÄpH=3.62 [c(H+) =2.4”Į10-4 mol/L ]£©£¬ŌŁĻņČÜŅŗÖŠ¼ÓČė×ćĮæµÄBa(OH)2ČÜŅŗ£¬¾¹żĀĖ”¢ĮĄøÉ”¢³ĘÖŲ£¬µĆ³ĮµķµÄÖŹĮæĪŖ0.1864g”£Čō¼ŁÉčÓźĖ®µÄĖįŠŌ½öÓÉNOxŗĶSO2µÄÅÅ·ÅĖłÖĀ”£Ēė¼ĘĖćÅÅ·ÅŌŚæÕĘųÖŠµÄNOxŗĶSO2µÄĪļÖŹµÄĮæÖ®±Č½Ó½üÓŚ ”ų ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com