
某同学称取一定质量的MgCl2固 体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
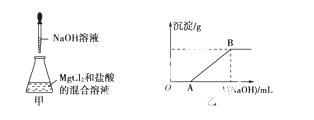
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有________(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为________________________________________________________________________。
(3)AB段反应的离子方程式为________________________________________________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为________________________。
科目:高中化学 来源: 题型:
已知某化学反应的平衡常数表达式为K=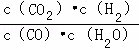 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
|
| A. | 该反应的化学方程式是CO(g)+H2O(g)═CO2(g)+H2(g) |
|
| B. | 上述反应的正反应是放热反应 |
|
| C. | 若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 |
|
| D. | 若平衡浓度符合下列关系式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一.请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似.已知断裂1mol N﹣N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量,请写出N4气体转变为N2反应的热化学方程式: N4(g)=2N2(g);△H=﹣882kJ/mol .
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
(3)在T1℃时,将5mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g)⇌4NO2(g)+O2(g);△H>0.反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%.
①求该反应的平衡常数K= 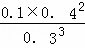 (数字代入式子即可),上述平衡体系中O2的体积分数为 12.5% .
(数字代入式子即可),上述平衡体系中O2的体积分数为 12.5% .
②用O2表示从0~5min内该反应的平均速率υ(O2)= 0.02mol/(L•min) .
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 AC .
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)⇌N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 B .
A.都引起a减小
B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO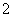 、SiO
、SiO 、SO
、SO 、CO
、CO 、SO
、SO 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
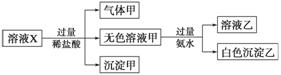
下列判断正确的是 ( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO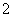 和SiO
和SiO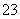 一定存在于溶液X中
一定存在于溶液X中
D.CO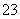 和SO
和SO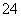 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对应化学反应的离子方程式正确的是
A.氨水中通入过量SO2:SO2+NH3·H2O===NH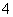 +HSO
+HSO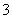
B.(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO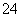 ===BaSO4↓
===BaSO4↓
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O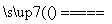 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO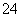 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO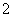 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中评价合理的是 ( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2Fe3O4+18H+===6Fe3++H2↑+8H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸:CO | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1∶2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】 NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
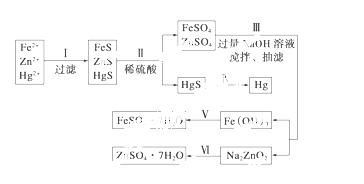
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为__________________________________。
(2)步骤Ⅲ中抽滤的目的是____________,该步骤产生Fe(OH)3的反应的离子方程式为
________________________________________________________________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为_________________________________________。
(4)欲实现步骤Ⅴ,需加入的试剂有________、________,所涉及的主要操作依次为_____________。
(5)步骤Ⅳ常用的方法是________,该步骤是否对环境有影响?________(填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:__________。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从矿物学资料查得,一定 条件下自然界存
条件下自然界存 在如下反应:14CuSO4+5FeS2+12H2O====7Cu2S+5FeS
在如下反应:14CuSO4+5FeS2+12H2O====7Cu2S+5FeS O4+12H2SO4。下列说法正确的是
O4+12H2SO4。下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
mol电子转移
C.产物中的SO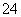 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.N a2O2 + 2HCl ==== 2NaCl + H2O2 B.Ag2O + H2O2 ==== 2Ag + O2↑ + H2O
a2O2 + 2HCl ==== 2NaCl + H2O2 B.Ag2O + H2O2 ==== 2Ag + O2↑ + H2O
C.2H2O2 ==== 2H2O + O2↑ D.3H2O2 + Cr2(SO4)3 + 10KOH ==== 2K2CrO4 + 3K2SO4 + 8H2O
(1)上述反应中,不属于氧化还原反应是__________。(填字母序号,下同)
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是__________。
(3)某强酸性反应体系中,反应物和生成物共六种物 质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应的离子方程式是__________ 。
②如果上述反应中有2.24L(标准状况)气体生成,转移的电子的物 质的量为__________mol。
质的量为__________mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2 + H2O ==== A + NH3↑,试指出生成物A的化学式为__________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________。
(5)请设计一个简单易行的实验证明过氧化氢具有氧化性。除过氧化氢外,供选择的试剂还有:氯水、稀硝酸、饱和硫化氢溶液。请将所选试剂和实验现象填入下表:
| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com