
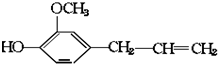
 其可能具有的性质是( )
其可能具有的性质是( )| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
科目:高中化学 来源: 题型:选择题
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1氨水中有NA个NH4+ | |
| B. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| C. | 1L 0.1mol•L-1Na2SO3溶液中含有 0.1NA个SO32- | |
| D. | 1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>NaCl>KCl | D. | CaO>BaO>KCl>NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
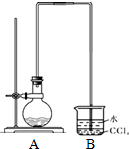 溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性):
溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性): .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
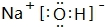 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com