
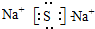 .
.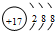 ,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.
,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.分析 (1)电子层越多,原子半径越大,同周期从左向右原子半径减小;钠与S形成离子化合物硫化钠;
(2)短周期中与氟元素同主族的元素为Cl,离子中质子数为17,电子数为18,HCl与氨气反应生成氯化铵;
(3)a.电子层越多,原子半径越大,同周期从左向右原子半径减小;
b.同周期从左向右非金属性增强;
c.非金属性越强,对应氢化物越稳定;
d.金属性越强,对应碱的碱性越强.
解答 解:(1)电子层越多,原子半径越大,同周期从左向右原子半径减小,则短周期中原子半径最大的元素为Na,位于周期表的第三周期第IA族,该元素与硫元素形成的化合物的电子式为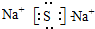 ,
,
故答案为:三;IA;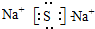 ;
;
(2)短周期中与氟元素同主族的元素为Cl,离子中质子数为17,电子数为18,离子结构示意图为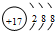 ,HCl与氨气反应生成氯化铵,该反应为NH3+HCl=NH4Cl,
,HCl与氨气反应生成氯化铵,该反应为NH3+HCl=NH4Cl,
故答案为:Cl(氯);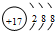 ;NH3+HCl=NH4Cl;
;NH3+HCl=NH4Cl;
(3)a.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Al>Si>C,故a正确;
b.同周期从左向右非金属性增强,则非金属性:P<S<Cl,故b错误;
c.非金属性越强,对应氢化物越稳定,则热稳定性:HF>H2O>H2S,故c错误;
d.金属性越强,对应碱的碱性越强,则碱性:KOH>Ca(OH)2>Mg(OH)2,故d错误;
故答案为:a.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定不含共价键 | B. | 化学键的形成与原子结构无关 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅含有碳元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
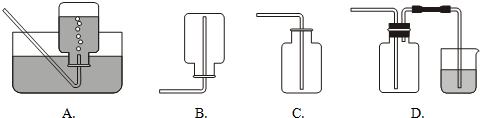
| 气体 | 所含杂质气体 | 除杂所用试剂 | 收集气体方法(已去除杂质) |
| 氨气 | 水蒸气 | a | B |
| 一氧化氮 | 二氧化氮 | b | A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液 Al+2OH-→AlO2-+H2↑ | |
| B. | 铁跟稀硫酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 浓氨水 | C. | 盐酸 | D. | 硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com