
 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. 及X的核磁共振氢谱如图2,其中
及X的核磁共振氢谱如图2,其中 的核磁共振氢谱图.写出X的结构简式:
的核磁共振氢谱图.写出X的结构简式:
 中含有三种类型的氢原子,氢原子的数目之比是1:2:2,所以核磁共振氢谱图Ⅰ符合,硫的有机物(
中含有三种类型的氢原子,氢原子的数目之比是1:2:2,所以核磁共振氢谱图Ⅰ符合,硫的有机物( )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.可以确定X的化学式为:C7H6SCl2,核磁共振氢谱图显示存在三种类型的氢原子,各种氢原子个数之比是1:1:1,所以结构简式为:
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.可以确定X的化学式为:C7H6SCl2,核磁共振氢谱图显示存在三种类型的氢原子,各种氢原子个数之比是1:1:1,所以结构简式为: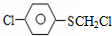 .
. .
.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①③④ | B、②③④ |
| C、②③⑤ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
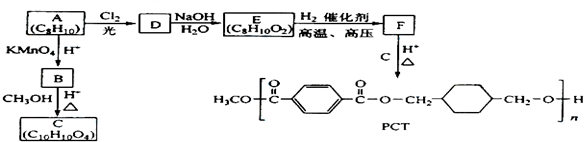
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、h1>h2>h3>h4 |
| B、h4>h3>h1>h2 |
| C、h4>h1>h3>h2 |
| D、h2>h3>h1>h4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ |
| 乙 醇 | -114 | 78 |
| 乙 酸 | 16.6 | 117.9 |
| 乙酸乙酯 | -83.6 | 77.5 |
| 98%H2SO4 | 10 | 338 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com