
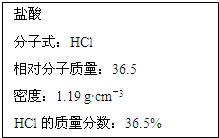
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:| 1000ρω |
| M |
| n |
| V |
| 1000×1.19×36.5% |
| 36.5 |
| 0.01mol |
| 0.400mol/L |
| n |
| V |


科目:高中化学 来源: 题型:
 在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)?nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所.下列结论正确的是( )
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)?nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所.下列结论正确的是( )| A、p1>p2 n<3 |
| B、p1<p2 n>3 |
| C、p1<p2 n=3 |
| D、p1>p2 n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L三氧化硫含有的分子数为NA |
| B、39克过氧化钠与足量的二氧化碳反应转移的电子数为NA |
| C、1mol甲基含有的电子数为7 NA |
| D、常温常压下,28克乙烯和环丙烷的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、试剂1可以选用石灰乳 |
| B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 |
| C、工业上,电解熔融MgO冶炼金属镁可减小能耗 |
| D、可用BaCl2溶液除去粗盐中的SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
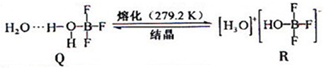
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 向盛有0.2g Na2O2的烧杯中加入50mL蒸馏水 | 剧列反应,产生能使带火星木条复燃的气体,得到的溶液a能产生丁达尔效应 |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
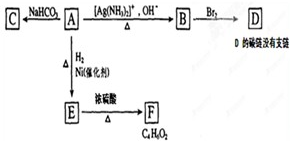
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com