
【题目】I.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3 + 3H2O ![]() Fe(OH)3(胶体) + 3HCl。
Fe(OH)3(胶体) + 3HCl。
①当溶液呈________时,停止加热,即制得Fe(OH)3胶体。
②氢氧化铁胶体与氢氧化铁沉淀的本质区别是____________________。
③下列叙述错误的是________。(单选)
A.雾属于胶体,能产生丁达尔效应
B.“PM2.5”悬浮在空气中形成胶体,危害人体健康 (“PM2.5”指大气中直径小于或等于2.5微米的细小颗粒物,也可称为可吸入肺颗粒物)
C.明矾、硫酸铁可以净水,净水原理和胶体有关
D.胶体在一定条件下能稳定存在,属于介稳体系
Ⅱ.现有下列纯净物:NaCl、SO3 、CH3COOH、石墨、HCl、蔗糖、乙醇、Fe、NaOH、H2SO4,其中
(1)固态能导电的是_________________________
(2)溶于水后形成的水溶液能导电的是___________________
(3)属于电解质的是_________________________________
(4)属于非电解质的是_________________________________
Ⅲ. 写出以下离子反应的离子方程式
(1)氢氧化钡溶液与硫酸铜混合:__________________________________________________
(2)氢氧化钠溶液中滴入稀硝酸:___________________________________________________
(3)稀盐酸除水垢中的碳酸钙:_____________________________________________________
(4)二氧化碳通入澄清石灰水中:___________________________________________________
(5)硝酸银溶液与稀盐酸反应:_____________________________________________________
【答案】红褐色 分散质粒子大小 B Fe、石墨 NaCl、SO3、CH3COOH、HCl、NaOH、H2SO4 NaCl、CH3COOH、HCl、NaOH、H2SO4 SO3 、蔗糖、乙醇 Ba2+ + 2OH- + Cu2+ + SO42- = BaSO4 ↓ + Cu(OH)2 ↓ OH- + H+ = H2O CaCO3 + 2H+= Ca2+ + H2O + CO2 ↑ CO2 + Ca2+ + 2OH- = CaCO3 ↓ + H2O Ag+ + Cl- = AgCl ↓
【解析】
I.①将饱和氯化铁滴加到沸水中,并加热至溶液呈红褐色,可以制备氢氧化铁胶体;
②根据分散系分为胶体、溶液和浊液的分类依据判断;
③结合胶体的分类方法和性质分析判断;
Ⅱ.根据物质导电的原因,结合电解质和非电解质的概念分析判断;
Ⅲ.首先书写化学方程式,然后将强酸、强碱和易溶性盐改写为离子形式,其余仍用化学式表示,据此书写反应的离子方程式。
I.①制备氢氧化铁胶体,可将饱和氯化铁滴加到沸水中,并加热至溶液呈红褐色,因胶体在加热易聚沉,当溶液呈红褐色停止加热,故答案为:红褐色;
②氢氧化铁胶体分散质粒子直径在1nm-100nm,而氢氧化铁沉淀的分散质粒子的直径大于100nm,本质区别是分散质粒子大小,故答案为:分散质粒子大小;
③A.雾的分散质粒子直径在1nm~100nm之间,是胶体,能产生丁达尔现象,故A正确;
B.PM2.5(小于2.5μm=2500nm)的直径大于胶体中的分散质粒子直径,所以不属于胶体,属于浊液,故B错误;
C.明矾净水是由于铝离子水解生成的氢氧化铝胶体而具有净水作用,硫酸铁净水是由于铁离子水解生成的氢氧化铁胶体而具有净水作用,均与胶体有关,故C正确;
D.胶体的稳定性介于溶液和浊液之间,是介稳体系,在一定条件下能稳定存在,故D正确;
故答案为:B;
Ⅱ.(1)Fe、石墨中有自由电子,能导电,故答案为:Fe、石墨;
(2)NaCl、CH3COOH、HCl、NaOH、H2SO4属于电解质,溶于水能够电离出自由移动的离子,水溶液能够导电,SO3溶于水与水反应生成H2SO4,在水溶液里能够电离出自由移动的离子,水溶液能够导电,故答案为:NaCl、SO3、CH3COOH、HCl、NaOH、H2SO4;
(3)电解质是在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水,故答案为:NaCl、CH3COOH、HCl、NaOH、H2SO4;
(4)非电解质是在水溶液里和熔融状态下都不能导电的化合物,所以SO3、蔗糖、乙醇是非电解质,故答案为:SO3 、蔗糖、乙醇;
Ⅲ. (1)氢氧化钡溶液与硫酸铜混合反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Ba2+ + 2OH- + Cu2+ + SO42- = BaSO4 ↓ + Cu(OH)2 ↓,故答案为:Ba2+ + 2OH- + Cu2+ + SO42- = BaSO4 ↓ + Cu(OH)2 ↓;
(2)氢氧化钠溶液中滴入稀硝酸反应生成硝酸钠和水,反应的离子方程式为OH- + H+ = H2O,故答案为:OH- + H+ = H2O;
(3)碳酸钙难溶于水,稀盐酸除水垢中的碳酸钙反应生成氯化钙、水和二氧化碳,反应的离子方程式为CaCO3 + 2H+= Ca2+ + H2O + CO2 ↑,故答案为:CaCO3 + 2H+= Ca2+ + H2O + CO2 ↑;
(4)二氧化碳通入澄清石灰水中反应生成碳酸钙沉淀和水,反应的离子方程式为CO2 + Ca2+ + 2OH- = CaCO3 ↓ + H2O,故答案为:CO2 + Ca2+ + 2OH- = CaCO3 ↓ + H2O;
(5)硝酸银溶液与稀盐酸反应生成氯化银沉淀和硝酸,反应的离子方程式为Ag+ + Cl- = AgCl ↓,故答案为:Ag+ + Cl- = AgCl ↓。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+
B.大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑
C.制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
D.少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种自热食品的自热包上标注的成分是铝粉、生石灰、小苏打,自热包打开后加水即可大量放热。加水过程中发生的主要反应不可能是
A. 2Al+Ca(OH)2+2H2O=Ca(AlO2)2+3H2↑
B. Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
C. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯(结构如图1所示)是食品行业中常用的一种香精,柠檬烯熔点为-74.3℃,沸点为177℃,难溶于水,在接近100℃时有一定的挥发性。柠檬、橙子和柚子等水果果皮中存在较多的柠檬烯,实验室通常用水蒸气蒸馏(装置如图2所示)的方法将柠檬烯从果皮中提取出来并进行后续的分离提纯。
水蒸气蒸馏:将60g橙子皮剪成碎片投入仪器B中,加入30mL蒸馏水,打开T形管活塞,点燃酒精灯加热水蒸气发生装置,待T形管支管口有大量水蒸气冒出时关闭活塞并开始通入冷凝水,当D中收集到约60~70mL馏出液时停止蒸馏。
分离提纯:将馏出液倒入分液漏斗,每次用10mL二氯甲烷(沸点39.95℃)萃取三次,萃取液合并后置于锥形瓶中,加入适量无水硫酸镁,半小时后过滤,将滤液进行蒸馏除去二氯甲烷,蒸馏烧瓶中得到主要成分是柠檬烯的橙油。
请回答相关问题。

(1)仪器A的名称是____。安全管下端不能抵住仪器A的底部,原因是__。仪器B中水蒸气导入管管口接近瓶底,目的是___。
(2)直形冷凝管填能否更换为球形冷凝管___(“能”或“否”),原因是___。
(3)分离提纯过程中加入无水硫酸镁的作用是____。对滤液进行蒸馏时合适的加热方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为______________,P的基态原子价层电子排布式为__________________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___________________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为_____________,其中心原子的杂化类型为_______________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________________,其中M离子的配位数为_____________,该晶体类型为____________________。
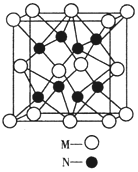
(5)该晶胞的边长为 a pm,则该晶体的密度为____________________g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的质量分数:w=![]() B.所得溶液的物质的量浓度为1 mol·L-1
B.所得溶液的物质的量浓度为1 mol·L-1
C.36.5 g HCl气体占有的体积为22.4 LD.所得溶液中含有NA个HCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是
A. 35.5a=(W2-W1)V2B. n(Al)>![]() mol
mol
C. n(Na)+3n(Al)=![]() molD. aV2=
molD. aV2=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
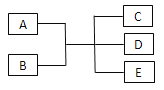
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com