
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
| 元素 | 相关信息 |
| X | X的基态原子核外的三个能级上电子数相等 |
| Y | Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z | Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W | 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)A元素原子的核电荷数为8,其原子核内的质子数为________,该元素原子的二价阴离子中,核外电子数为________,中子数是9的核素表示为________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
(3)A、B形成1∶1型化合物的相对分子质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | | |||||
| 二 | ② | | | ③ | ④ | ⑤ | ⑥ |
| 三 | ⑦ | ⑧ | | | | ⑨ | ⑩ |
| 四 | ? | | ? | | | | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息: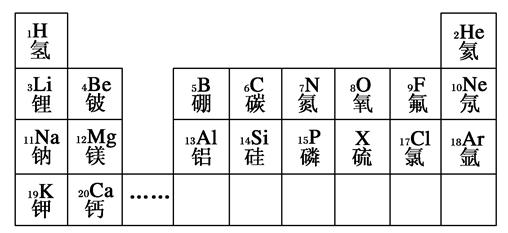
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析上表规律,可推知,表中X为________。
(3)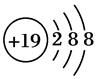 表示的是(写粒子符号)________。
表示的是(写粒子符号)________。
(4)写出一个由1、7、17号三种元素组成的化合物的化学式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于第 周期第 族;A与C形成的离子化合物的化学式为 _________________ ; A与C形成的离子化合物与水反应的化学方程式为 。
(2)C形成的简单离子的离子结构示意图为 。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________ 。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列关于元素周期律和元素周期表的论述中正确的是( )。
| A.同一主族的元素从上到下金属性逐渐减弱 |
| B.元素周期表是元素周期律的具体表现形式 |
| C.同一周期从左到右,元素原子半径逐渐增大 |
| D.非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com