
| A��Cu��Cu2O�����ʵ���֮��Ϊ2��1 |
| B����������ʵ���Ũ��Ϊ2 mol/L |
| C��Cu��Cu2O�����ᷴӦ��ʣ��HNO3�����ʵ���Ϊ0.5mol |
| D��������NO�ڱ�״���µ����Ϊ2.24L |
| 19.6g |
| 98g/mol |
| n |
| V |
| 19.6g |
| 98g/mol |
| 0.6mol |
| 0.25L |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�������ӵĽṹʾ��ͼ  |
| B��HClO��Cl�Ļ��ϼ�Ϊ��+1 |
| C���Ȼ��ƵĻ�ѧʽ��CaCl |
| D������ĵ��뷽��ʽ��H2SO4=H2++SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��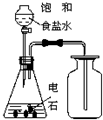 �Ʊ����ռ���Ȳ |
B�� ��ȥ�Ҵ������е��������� |
C�� �Ʊ������������� |
D�� ʯ�͵ķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� |
| �ŵ� |
| A���õ�طŵ�ʱ���������������� |
| B���ŵ�ʱ�������ĵ缫��ӦʽΪPbO2+4H++2e-�TPb2++2H2O |
| C�����ʱ����Һ��Pb2+�������ƶ� |
| D�����ʱ��������Χ��Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A����B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᣬ��ͼ��ʾ��
A����B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᣬ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Һ��MgCl2�����ʵ���Ϊ0.2mol |
| B����87.5mL NaOH������Һʱ����������� |
| C��������90.0mL NaOH��Һʱ����Һ��NaAlO2��NaCl�����ʵ���֮��Ϊ2��35 |
| D����100mL NaOH��Һ�պ���ȫ����ʱ��Al3+ ǡ����ȫת��ΪAlO2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ij��Һ����μ���ϡ���ᣬ���ְ�ɫ��״�������ټ�������NaOH��Һ��������ʧ��˵��ԭ��Һ�д���AlO2- |
| B����ij��Һ�еμ�KSCN��Һʱ���ɫ��˵����Һ�в�����Fe2+ |
| C���ü���ʼ���Fe��OH��3�����Fe��SCN��3��Һ |
| D���ò�˿պȡij��Һ����ɫ���������գ�����ʻ�ɫ��֤�����в���K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮϡ�����У�c��H+����c��OH-�� ��ֵ���� | ||
| B������������Ϣ�����ƶ�NH3?H2OΪ������� | ||
C����pH=11.12�� NaOH��Һ��ȣ�NaOH��Һ��c��Na+�� ���ڰ�ˮ��c��NH
| ||
| D����������NH4Cl ���壬��Һ��ˮ�ĵ���ƽ�⣺H2O?H++OH-�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com