
【题目】下列离子反应方程式正确的是( )
A. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2= 2Fe3++2H2O
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C. 铁和稀硝酸反应:Fe+ 2H+=Fe2++ H2↑
D. 硫酸氢钠溶液中逐滴加入氢氧化钡溶液直至溶液呈中性: H++ SO42- + OH-+ Ba2+ = BaSO4↓+H2O
【答案】AB
【解析】
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故A正确;
B.电解饱和食盐水,生成氢气、氯气、和氢氧化钠,反应的离子方程式为2Cl-+2H2O ![]() H2↑+C12↑+2OH-,故B正确;
H2↑+C12↑+2OH-,故B正确;
C.铁与稀硝酸反应生成一氧化氮,不会生成氢气,硝酸足量生成硝酸铁和一氧化氮,硝酸少量生成硝酸亚铁与一氧化氮,故C错误;
D.恰好反应呈中性,说明氢离子的量和氢氧根离子的量相等,正确的离子方程式为 Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D错误;
故选AB。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 萘(![]() )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
)是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
B. 酚酞的结构如图所示,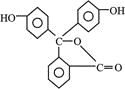 其结构中含有羟基(—OH),故酚酞属于醇
其结构中含有羟基(—OH),故酚酞属于醇
C. 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来
D. ![]() 的名称为2-甲基-4-戊醇
的名称为2-甲基-4-戊醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
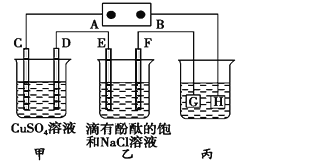
(1) A为电源的_____极,写出甲中C的电极反应式________。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__。
(3) 现用丙装置给铜件镀银,电镀液是______溶液。当乙中溶液的c(OH-)=0.1 molL1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铁的氧化物样品,用150 mL 5 mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气1.68L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是
A.NaOH溶液,W1=W2B.无水乙醇,W1=W2
C.NaHSO4溶液,W1<W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒研究提出的苯分子结构模型如图所示:
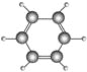
(1)请根据苯的分子结构模型,写出苯的分子式_______,结构式____________,结构简式________________。
(2)向试管中加入3 mL酸性高锰酸钾溶液,再加入1 mL苯,振荡试管。观察到的实验现象是_______________。
(3)向试管中加入1 mL溴水,再加入3 mL苯,振荡试管。观察到的实验现象是_____________。
(4)你认为凯库勒提出的苯的分子结构符合实验事实吗?________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的45倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
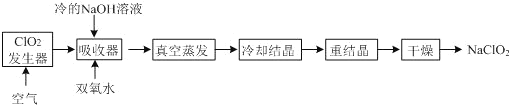
(1)吸收器中反应的离子方程式为________,吸收器中的反应温度不能过高,可能的原因_______。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________。
(3) ClO2发生器中的反应为2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4,实际工业生产中可用硫磺、浓硫酸代替反应原料中的SO2,其原因是______(用化学方程式表示)。
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
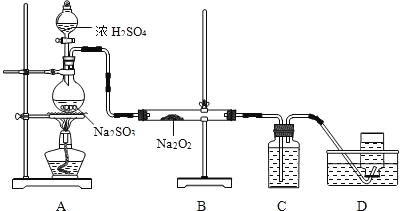
①为除去过量的SO2,C中盛放的试剂为______________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内发生反应的化学方程式为_______。
③有同学认为B中硬质玻璃管内可能还有NaSO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
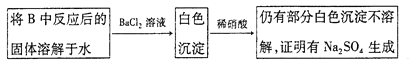
同学们经过讨论,认为上述方案不合理,其理由是:a____________;b_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com