

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
分析 A.左边电极上电极反应式为2H2O-4e-═4 H++O2↑,生成的H+通过交换膜进入浓缩室;
B.右边电极反应式为2H2O+4e-═2OH-+H2↑,溶液中A-从右侧通过交换膜II进入浓缩室;
C.阳极上水失电子生成氢离子和氧气;
D.400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则生成的乳酸物质的量=0.4L×(0.6-0.1)mol/L=0.02mol,转移n(H+)等于生成n(HA)为0.02mol,同时转移电子物质的量为0.02mol,根据2H2O+2e-═2OH-+H2↑,计算生成氢气体积.
解答 解:A.左边电极上电极反应式为2H2O-4e-═4 H++O2↑,生成的H+通过交换膜I进入浓缩室,所以交换膜I为阳离子交换膜,A-从阴极通过向浓缩室移动,故A错误;
B.右边电极反应式为2H2O+4e-═2OH-+H2↑,溶液中A-从右侧通过交换膜II进入浓缩室,所以II为阴离子交换膜,氢离子从阳极通过阳离子交换膜进入浓缩室,故B错误;
C.阳极上水失电子生成氢离子和氧气,电极反应式为2H2O-4e-═4 H++O2↑,故C正确;
D.400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则生成的乳酸物质的量=0.4L×(0.6-0.1)mol/L=0.02mol,转移n(H+)等于生成n(HA)为0.02mol,同时转移电子物质的量为0.02mol,根据2H2O+2e-═2OH-+H2↑知,生成氢气的物质的量为0.01mol,在标况下的体积是2.24L,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,正确判断阴阳离子交换膜及各个电极上发生的反应是解本题关键,同时考查学生分析判断能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂,也可以通过分馏提取得到汽油 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | NH4HCO3受热能分解产生气体,在食品工业中可作为焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X形成的化合物只含有离子键 | B. | 原子半径:Y>Z>W | ||
| C. | 还原性:W2->Y2- | D. | 氧化物的水化物酸性:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的KHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | CH3COONa和BaCl2混合溶液:c(Na+)+c(Ba2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| C. | 三种相同浓度的铵盐溶液中c(NH4+)从大到小的顺序:NH4HSO4、NH4Cl、NH4HCO3 | |
| D. | 已知AgCl、AgBr、AgI溶度积常数依次为1.6×l0-10、7.7×10-13、8.7×10-17,则对应饱和溶液中c(X-)从大到小的顺序为:Cl-、Br-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z、M的单质均不能与冷水反应 | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | 气态氢化物的热稳定性:Y<N<R | |
| D. | 简单离子半径:M<Z<Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
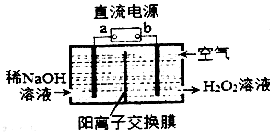 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.
纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com