
| A. | NO | B. | Na2O2 | C. | FeCl2 | D. | CuCl2 |
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Li>Na>K>Rb>Cs | |
| B. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 与水反应的剧烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空气中燃烧生成R2O(R表示碱金属) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
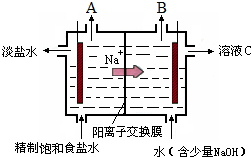 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁元素在元素周期表中位于第三周期、第ⅡB族 | |
| B. | 第②步洗涤完毕后向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 | |
| C. | 在工业生产上可用NaOH溶液代替石灰乳 | |
| D. | 步骤⑤也可以采用电解该晶体水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
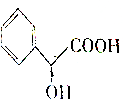 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com