
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑧ | |||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |

 ;
;分析 根据各元素在元素周期表的相对位置可知,①②③④⑤⑥⑦⑧元素分别为H、Na、C、N、Cl、Ar、K、O,
(1)元素周期表中左下角的元素的金属性最强,八种元素中,金属性最强的元素为K,其最高价氧化物对应水化物为KOH,氢氧化钾溶液与Al反应生成偏铝酸钾和氢气;
(2)元素①和⑧形成的原子个数比为1:1的化合物为双氧水,双氧水为共价化合物,分子中含有两个极性键O-H键和1个非极性键O-O键;元素②和⑧形成的原子个数比为1:1的化合物为过氧化钠,过氧化钠为离子化合物,电子式中需要标出阴阳离子的所带电荷,过氧根离子还需要标出最外层电子;
(3)⑤和②形成的化合物为NaCl,氯化钠为离子化合物,用电子式表示出氯化钠的形成过程;
(4)元素④的最高价氧化物的水化物的稀溶液为稀硝酸,铜与稀硝酸反应生成硝酸铜、NO气体和水;
(5)元素⑤单质为氯气,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:根据各元素在元素周期表的相对位置可知,①②③④⑤⑥⑦⑧元素分别为H、Na、C、N、Cl、Ar、K、O,
(1)①②③④⑤⑥⑦⑧八种元素中,金属性最强的元素为K,K的最高价氧化物对应水化物为KOH,氢氧化钾溶液与Al反应化学方程式为:2Al+2KOH+2H2O═2KAlO2+3H2↑,
故答案为:2Al+2KOH+2H2O═2KAlO2+3H2↑;
(2)元素①和⑧分别为H、O,二者形成的原子个数比为1:1的化合物为双氧水,双氧水为共价化合物,其结构式为:H-O-O-H,其分子中含有的化学键为极性键和非极性键;
元素②和⑧形成的原子个数比为1:1的化合物为过氧化钠,过氧化钠为离子化合物,其电子式为:,
故答案为:H-O-O-H;极性键 非极性键; ;
;
(3)⑤和②形成的化合物为NaCl,NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,用电子式表示氯化钠的形成过程为: ,
,
故答案为: .
.
(4)元素④的最高价氧化物的水化物的稀溶液为稀硝酸,铜与稀硝酸反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO+4H2O;
(5)元素⑤单质为Cl2,氯气有毒,需要用碱液吸收,氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═2Cl-+ClO-+2H2O,
故答案为:Cl2+2OH-═2Cl-+ClO-+2H2O.
点评 本题考查了位置、结构与性质的应用,题目难度中等,涉及离子方程式书写、电子式、化学键、化学方程式等知识,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
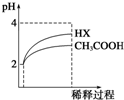 25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7
25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | Ca+H2O═Ca(OH)2 | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当pH=7时,c(Na+ )=c(CH3 COO- )>c(H+ )=c(OH- ) | |
| B. | 当pH>7时,c(CH3 COO- )>c(Na+ )>c(OH- )>c(H+ ) | |
| C. | 当恰好完全中和时,c(Na+ )>c(CH3 COO- )>c(OH- )>c(H+ ) | |
| D. | 无论溶液显什么性都有关系:c(Na+ )+c(H+ )=c(CH3 COO- )+c(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤是由有机物和无机物组成的复杂混合物 | |
| D. | 石油含有C5~C11的烷烃,可以通过石油的分馏得汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com