
| ʵ����� | Ԥ����������� |
| ����1��ȡ����Ʒ����Һ���Թ��У��ټ���������______�� | ��Ʒ����Һ��ɫ�������1������ |
| ����2��______ ______ ______�� | ��______�������2������ |
| ���ݲ���1��2�� | ��______�������3������ |
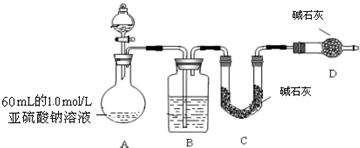
| ʵ����� | Ԥ����������� |
| 1.0 mol?L-1 NaClO��Һ | |
| ��ȡ����Ʒ����Һ���Թ��У��ټ���������1.0 mol?L-1 Na2SO3��Һ�� | Ʒ����Һ��ɫ |
| ����1��2��Ʒ����Һ������ɫ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ�� ��� |
ʵ����� | ���� | ���� |
| �� | ����ˮ����Ʒ����Һ | Ʒ����Һ��ɫ | ������ˮ��Ӧ�IJ�����Ư���� |
| �� | ��ˮ�м���̼�����Ʒ�ĩ | ����ɫ������� | ������ˮ��Ӧ�IJ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ�� ��� |
ʵ����� | ���� | ���� |
| �� | ����ˮ����Ʒ����Һ | Ʒ����Һ��ɫ | ������ˮ��Ӧ�IJ�����Ư���� |
| �� | ��ˮ�м���̼�����Ʒ�ĩ | ����ɫ�� �ݲ��� |
������ˮ��Ӧ�IJ���������� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
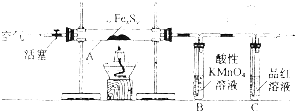
| �ζ����� | ������Һ���/mL | ������Һ���/mL | |
| �ζ�ǰ�̶� | �ζ���̶� | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| ��� | �¶�/�� | �ữ��H2C2O4��Һ/mL | KMnO4��Һ/mL | ��Һ��ɫʱ��/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 ����������������ˮMnSO4��ĩ�� |
2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ �� �� �� | Ԥ������ʵ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com