
分析 (1)①增大浓度、升高温度、增大压强、加入催化剂均能加快化学反应速率;
②a.平衡前,随着反应的进行,气体的物质的量减小,故容器内压强始会减小;
b.温度为变量,当容器内温度不再变化时,反应达到了平衡;
c.平衡时,其他条件不变,正反应是放热反应;
d.反应热效应与催化剂无关;
③根据平衡常数的定义书写表达式为:K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$,根据V=$\frac{△c}{△t}$计算速率;该温度下、该容器中,再继续加入1mol的SO2(g),平衡正向移动;
(2)①该温度下、该容器中,再继续加入1mol的SO2(g),平衡正向移动;在2L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,转化的SO2为2mol×50%=1mol,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):2 2 0 0
转化量(mol):1 1 1 1
平衡量(mol):1 1 1 1
再根据K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$计算平衡常数;
再继续加入1mol的SO2(g),等效为开始加入3mol的SO2(g)和2mol的NO2(g),设平衡时容器中SO2(g)的浓度是xmol/L,表示出其它组分的平衡浓度,再根据平衡常数列方程计算;SO2、NO2起始物质的量之比为1:1,又按物质的量1:1反应,二者转化率相等,根据三行式的计算可知新平衡时SO2的转化率、NO2的转化率;
②增大一种反应物的用量,其转化率将减小,另一反应物的转化率将增大,现实生产中的意义是:可以通过增大低成本物质的用量,来提高成本高的反应物的利用率.
解答 解:(1)①a.减压,减小速率,故错误;
b.增加SO2的浓度,加快反应速率,故正确;
c.升温,加快反应速率,故正确;
d.及时移走产物,相对于减小浓度,减小反应速率,故错误;
故答案为:bc;
②a.平衡前,随着反应的进行,气体的物质的量减小,故容器内压强始会减小,故错误;
b.温度为变量,当容器内温度不再变化时,反应达到了平衡,故正确;
c.平衡时,其他条件不变,正反应是放热反应,所以升高温度K减小,故错误;
d.反应热效应与催化剂无关,故错误;
故答案为:acd;③根据平衡常数的定义书写表达式为:K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$,2L容器中,10分钟内,气体密度减小了8g/L,则减少的S为0.25mol/L,变化的CO的浓度为0.5mol/L,故CO的反应速率是0.05mol/(L﹒min),故答案为:$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})•{c}^{2}(CO)}$;0.05mol/(L﹒min);
(2)①在2L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,转化的SO2为2mol×50%=1mol,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):2 2 0 0
转化量(mol):1 1 1 1
平衡量(mol):1 1 1 1
平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$=$\frac{\frac{1}{2}×\frac{1}{2}}{\frac{1}{2}×\frac{1}{2}}$=1
再继续加入1mol的SO2(g),等效为开始加入3mol的SO2(g)和2mol的NO2(g),设平衡时容器中SO2(g)的浓度是xmol/L,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L):1.5 1 0 0
转化量(mol/L):1.5-x 1.5-x 1.5-x 1.5-x
平衡量(mol/L):x x-0.5 1.5-x 1.5-x
所以$\frac{(1.5-x)^{2}}{x(x-0.5)}$=1,解得x=0.9mol/L,
SO2、NO2起始物质的量之比为1:1,又按物质的量1:1反应,二者转化率相等,故NO2的转化率为50%;新平衡时SO2的转化率=$\frac{1.5-0.9}{1.5}$×100%=40%、NO2的转化率=$\frac{1.5-0.9}{1}$×100%=60%;
故答案为:正;0.9mol/L;40%;50%;60%;
②增大一种反应物的用量,其转化率将减小,另一反应物的转化率将增大,现实生产中的意义是:可以通过增大低成本物质的用量,来提高成本高的反应物的利用率,
故答案为:减小;增大;低成本物质.
点评 本题考查化学平衡有关计算,涉及平衡常数计算及应用,掌握三段式解题法在化学平衡计算中应用,注意平衡常数有关应用.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓ | |
| D. | 盐酸跟氢氧化镁反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 67% | B. | 50% | C. | 25% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?④>①=②>③ | B. | ?④>①>②=③ | C. | ?④=①>②>③ | D. | ?①=②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
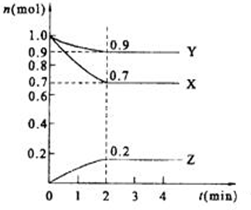 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 1 | 2 | 3 |
| 200 | $\frac{8}{3}$ | $\frac{4}{3}$ | $\frac{8}{9}$ |
| 300 | 2.4 | 1.2 | 0.8 |
| 400 | 2.0 | 1.0 | $\frac{2}{3}$ |
| A. | m=2,△H>0 | |
| B. | 300℃时,该反应平衡常数 K=9 | |
| C. | 在3L容器中进行反应,达到平衡的时间:400℃>200℃ | |
| D. | 200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 3 | C. | 1 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中有Fe2+和Cu2+ | B. | 溶液中只有Fe2+ | ||
| C. | 有铜粉无铁粉 | D. | 有铁粉无铜粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com