
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
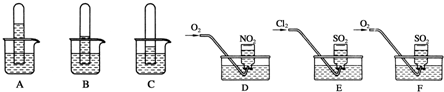
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 铝丝先放在NaOH溶液中浸泡1min,取出用蒸馏水冲洗后放在浓硝酸中浸10min,最后放入CuSO4溶液中,铝丝表面无铜析出,说明Al常温下与CuSO4溶液不反应 | |
| C. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol/L)通常需要用容量瓶等仪器 | |
| D. | 固体碘单质受热易升华,说明碘单质的热稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Br-、SO42- | |
| B. | 原溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验无关,可以省略 | |
| D. | 若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com