
分析 (1)乙是两性氢氧化物,应为Al(OH)3,则10电子的单核微粒甲为Al3+;
(2)乙是碱性气体,应为NH3,则甲为NH4+;
(3)根据溶液整体呈电中性及考虑离子共存,应为Fe3+;
(4)根据电离平衡常数k=$\frac{c({H}^{+})c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$计算;
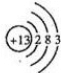
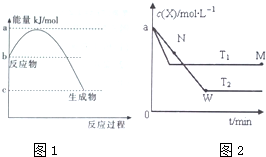
(5)由图可知,温度为T1先到达平衡,所以T1>T2,
(6)温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动;
(7)升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,根据图象判断参加反应的X的量的多少,反应的X越多,放热越多.
解答 解:(1)乙是两性氢氧化物,应为Al(OH)3,则10电子的单核微粒甲为Al3+,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)乙是碱性气体,应为NH3,则甲为NH4+,根据图中信息分析,反应为吸热反应,反应的热化学方程式是NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ•mol-1,
故答案为:NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ•mol-1;
(3)Fe2+在酸性条件下与NO3-发生氧化还原反应被氧化,Ba2+与SO42-反应生成沉淀而不能共存,溶液不可能只含有阴离子,则只能含有Fe3+,故答案为:D;
(4)pH=10,则c(H+)=10-amol/L,HCO3-和CO32-的物质的量浓度相等,则HCO3-的电离平衡常数Ka=$\frac{c({H}^{+})c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$=10-a,故答案为:10-a;
(5)由图可知,先拐先平,温度高,温度为T1先到达平衡,所以T1>T2,故答案为:>;
(6)温度越高反应速率越大,已知T1>T2,则N点的逆反应速率V逆小于M点的正反应速率V正,故答案为:>;
(7)进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故答案为:更少.
点评 本题考查较为综合,在无机物的推断的基础上考查物质的结构、热化学方程式、化学平衡以及弱电解质的电离等问题,题目难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
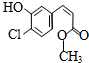
| A. | 该有机物的摩尔质量为200 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、消去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是钢与玻璃纤维形成的复合材料 | |
| B. | 氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 石油化工废弃物易造成水体富营养化 | |
| D. | 硫酸铵是常用的一种硝态氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物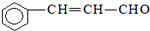 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 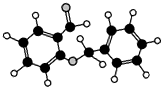 如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
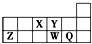
| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
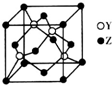 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
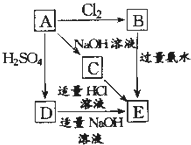 在如图式中,E是不溶于水的白色胶状物质,试推断:
在如图式中,E是不溶于水的白色胶状物质,试推断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com