
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 硬度由大到小:金刚石>晶体硅>碳化硅 |
分析 A.分子晶体的相对分子质量越大,熔沸点越大;
B.离子半径越小、离子键越强,则晶格能越大;
C.金属离子的电荷越大、半径越小,其熔点越大;
D.键长越短,共价键越强,硬度越大.
解答 解:A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,故A错误;
B.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故B正确;
C.金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,故C错误;
D.键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小为金刚石>碳化硅>晶体硅,故D错误;
故选B.
点评 本题考查了晶体熔沸点的比较、晶格能的比较、晶体硬度的比较等,注意把握影响物质熔沸点的、硬度和晶格能的因素是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
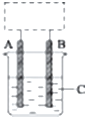 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | B. | 通入H2S,HS-浓度减小 | ||
| C. | 升高温度,$\frac{c(H{S}^{-})}{c({S}^{2-})}$增大 | D. | 加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该电池放电时负极材料是Cd | B. | 该电池放电时是化学能转化为电能 | ||
| C. | 该电池充电时会消耗NiO(OH) | D. | 该电池充电时Cd(OH)2 会失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a可能等于b | B. | a一定小于b | C. | a可能大于b | D. | a一定大于b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 0.4mol/L | B. | SO2 0.25mol/L | ||
| C. | SO2 和SO3均为0.15mol/L | D. | O2 0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com