
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
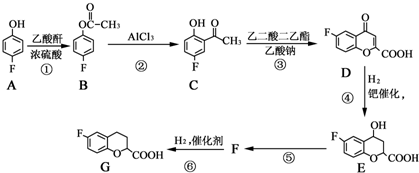
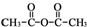
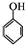 和乙酸酐为原料制备
和乙酸酐为原料制备 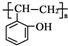 的合成路
的合成路| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
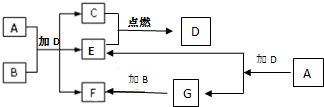 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 6 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、热量值关系一定满足:a=c<92.4 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时氨气的体积分数:①<② |
| D、N2的转化率:①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com