
| ʱ��/min | c��CO�� | c��H2O����g�� | c��CO2�� | c��H2�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
���� ��1����2C3H8��g��+7O2��g��=6CO��g��+8H2O ��l����H1=-2741.8kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566kJ/mol
���ݸ�˹�����齫����ʽ$\frac{��+3����}{2}$����õ����Ȼ�ѧ��Ӧ����ʽ��
��2��ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ��������ڲ��������������ƶ������������ƶ���
��3���ٿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�������Ũ�ȡ��ٷֺ����ȶ����䣻
��2min����CO��ʾ�ĸ÷�Ӧ����v=��$\frac{0.20mol/L-0.138mol/L}{2min}$=0.031 mol/��L•min�����¶Ⱥ��������ʱ����4��5min֮�䣬ƽ�����淴Ӧ�����ƶ����ı������Ϊ����H2Ũ���ǣ��ɱ���֪��5��6min֮�䣬����H2O��g��Ũ�ȣ���3minʱ�ﵽƽ�⣬T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K=$\frac{c��{H}_{2}��c��C{O}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{0.100��0.100}{0.100��0.200}$=0.5��
CO ��g��+H2O��g��?CO2��g��+H2 ��g��
��ʼ����mol/L�� 0.2 0.3 0 0
�仯����mol/L�� 0.1 0.1 0.1 0.1
ƽ������mol/L�� 0.1 0.2 0.1 0.1
4minʱ���������������䣬������ƽ����ϵ�м���0.1molCO��0.1molCO2��0.1molH2������Ũ����Qc��ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
��420��ʱ����μӷ�Ӧ��CO��Ũ��Ϊx����K=$\frac{c��{H}_{2}��c��C{O}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{x��x}{��0.01-x����0.01-x��}$=9����֮��x=0.0075mol/L�����ڴ������µ�ת����=$\frac{������}{��ʼ��}$��100%��397��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ12�������¶�ƽ��������Ӧ�����ƶ���
��� �⣺��1����2C3H8��g��+7O2��g��=6CO��g��+8H2O ��l����H1=-2741.8kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566kJ/mol
������ʽ$\frac{��+3����}{2}$��C3H8��g��+5O2��g��=3CO2��g��+4H2O ��l����H=$\frac{-2741.8+3����-566��}{2}$kJ/mol=-2219.9kJ/mol��
�ʴ�Ϊ��-2219.9kJ/mol��
��2����ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ�����Ը�����ͨ��������DZ��飬������ڲ��������������ƶ������������ƶ��������������ƶ���
������ӦʽΪC3H8+10O2--20e-=3CO2+4H2O��
�ʴ�Ϊ��B��
��3����a���÷�Ӧǰ�����������֮�Ͳ��䣬����ѹǿʼ�ղ��䣬���ܸ���ѹǿȷ����Ӧ�Ƿ�ﵽƽ��״̬����a����
b����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�ʼ�մ���v ����H2��=v ����CO����������H2��=������CO��˵��һ����̼���淴Ӧ������ͬ���ܾݴ��ж�ƽ��״̬����b��ȷ��
c���÷�Ӧ���������������䡢�������ʵ������䣬������Է�������ʼ�ղ��䣬���Բ��ܾݴ��ж�ƽ��״̬����c����
d��CO2��Ũ�Ȳ��ٷ����仯ʱ���÷�Ӧ�ﵽƽ��״̬����d��ȷ��
��ѡb d��
�ʴ�Ϊ��bd��
��2min����CO��ʾ�ĸ÷�Ӧ����v=��$\frac{0.20mol/L-0.138mol/L}{2min}$=0.031 mol/��L•min�����¶Ⱥ��������ʱ����4��5min֮�䣬ƽ�����淴Ӧ�����ƶ����ı������Ϊ����H2Ũ���ǣ��ɱ���֪��5��6min֮�䣬����H2O��g��Ũ�ȣ���3minʱ�ﵽƽ�⣬T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K=$\frac{c��{H}_{2}��c��C{O}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{0.100��0.100}{0.100��0.200}$=0.5��
CO ��g��+H2O��g��?CO2��g��+H2 ��g��
��ʼ����mol/L�� 0.2 0.3 0 0
�仯����mol/L�� 0.1 0.1 0.1 0.1
ƽ������mol/L�� 0.1 0.2 0.1 0.1
4minʱ���������������䣬������ƽ����ϵ�м���0.1molCO��0.1molCO2��0.1molH2������Ũ����Qc=$\frac{��0.1+0.1������0.1+0.1��}{��0.1+0.1����0.2}$=1��k=0.5����Ӧ������У�
�ʴ�Ϊ��0.031 mol/��L•min�����棻
��420��ʱ����μӷ�Ӧ��CO��Ũ��Ϊx����K=$\frac{c��{H}_{2}��c��C{O}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{x��x}{��0.01-x����0.01-x��}$=9����֮��x=0.0075mol/L�����ڴ������µ�ת����Ϊ$\frac{0.0075mol/L}{0.01mol/L}$��100%=75%��397��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ12�������¶�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��0��
�ʴ�Ϊ��75%������
���� ���⿼����ۺϣ��漰ԭ���ԭ������ѧƽ��״̬���жϡ���˹���ɵ�֪ʶ�㣬�ѵ���ƽ��״̬���жϡ��缫��Ӧʽ��д��ע�⡰ֻ�з�Ӧǰ��ı����������������Ϊƽ��״̬���ж����ݣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ��������� |
| T | ʧȥһ�����Ӻ��γ���Ne��ͬ�ĺ�������Ų� |
| X | �����������Ǵ�����������2�� |
| Y | ��ij�ֵ����ǿ�������Ҫ�ɷ֣�Ҳ���������ȼ�� |
| Z | ԭ�Ӻ�����3�����Ӳ㣬�����ȴ������1������ |
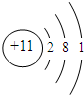 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͭ��ϡ���ᷴӦ O2-+2H+�TH2O | |
| B�� | ��̼��������Һ�еμ�ϡ���HCO3-+H+�TH2O+CO2�� | |
| C�� | ����������Һ��ϡ���ᷴӦ��Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| D�� | �����ʯ��ˮ��ͨ������CO2��CO2+OH-�THCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��
����I2O5������CO��Ⱦ�����ⶨCO����ӦΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com