
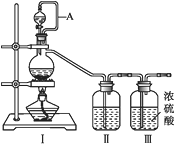
ЁОЬтФПЁПЗњрХЕЭЊЪЧШЫЙЄКЯГЩЕФПЙОњвЉЃЌЦфжаМфЬхGЕФКЯГЩТЗЯпШчЯТЃК
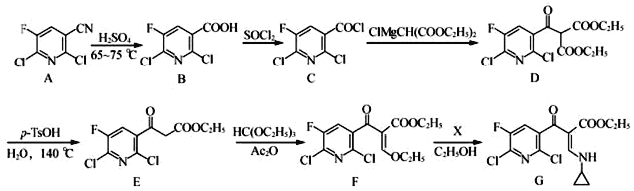
(1)GжаЕФКЌбѕЙйФмЭХЮЊ_____КЭ_____(ЬюУћГЦ)ЁЃ
(2)гЩCЁњDЕФЗДгІРраЭЪЧ_____ЁЃ
(3)ЛЏКЯЮяX(ЗжзгЪНЮЊC3H7N)ЕФНсЙЙМђЪНЮЊ_____ЁЃ
(4)EЕНFЙ§ГЬжаЕФЗДгІЮяHC(OC2H5)3жазюЖрга_____ИіЬМдзгЙВУцЁЃ
(5)BКЭввДМЗДгІЕФВњЮяЮЊH(C8H6FCl2NO2)ЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН_______________ ЁЃ
аДГіТњзуЯТСаЬѕМўЕФHЕФЫљгаЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК_____________ЁЃ
ЂёЃЎЪЧвЛжжІСЉАБЛљЫсЃЛ
ЂђЃЎЗжзгжага4жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗжзгжаКЌгавЛИіБНЛЗЁЃ
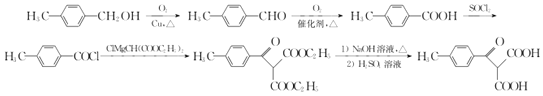
(6)ИљОнвбгажЊЪЖВЂНсКЯЯрЙиаХЯЂЃЌаДГівд ![]() КЭClMgCH(COOC2H5)2ЮЊдСЯжЦБИ
КЭClMgCH(COOC2H5)2ЮЊдСЯжЦБИ ЕФКЯГЩТЗЯпСїГЬЭМ(ЮоЛњЪдМСШЮбЁЃЌКЯГЩТЗЯпСїГЬЭМЪОР§МћБОЬтЬтИЩ)_____________ЁЃ
ЕФКЯГЩТЗЯпСїГЬЭМ(ЮоЛњЪдМСШЮбЁЃЌКЯГЩТЗЯпСїГЬЭМЪОР§МћБОЬтЬтИЩ)_____________ЁЃ
ЁОД№АИЁПѕЅЛљ єЪЛљ ШЁДњЗДгІ ![]() 5
5 ![]()
![]()
![]()
![]()
![]()
 Лђ
Лђ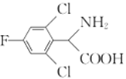 Лђ
Лђ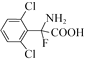 Лђ
Лђ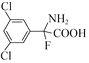
ЁОНтЮіЁП
(1)НсКЯГЃМћЕФЙйФмЭХЕФНсЙЙКЭУћГЦЗжЮіНтД№ЃЛ
(2)ЖдБШCЁЂDЕФНсЙЙЃЌПЩжЊCжаѕЃТШжаТШдзгБЛ-CH(COOC2H5)2ЬцДњЩњГЩDЃЛ
(3)ЛЏКЯЮяXЕФЗжзгЪНЮЊC3H7NЃЌЖдБШFЁЂGЕФНсЙЙЃЌFжа-OCH3БЛ![]() ЬцДњЩњГЩGЃЌЭЌЪБЩњГЩМзДМЃЌОнДЫЗжЮіХаЖЯXЕФНсЙЙЃЛ
ЬцДњЩњГЩGЃЌЭЌЪБЩњГЩМзДМЃЌОнДЫЗжЮіХаЖЯXЕФНсЙЙЃЛ
(4)ИљОнМзЭщЮЊЫФУцЬхНсЙЙЃЌЕЅМќПЩвда§зЊЃЌЗжЮіХаЖЯЃЛ
(5)H(C8H6FCl2NO2)ЕФвЛжжЭЌЗжвьЙЙЬхТњзуЃКЂёЃЎЪЧвЛжжІС-АБЛљЫсЃЌЫЕУїАБЛљЁЂєШЛљСЌНгЭЌвЛЬМдзгЩЯЃЌЂђЃЎЗжзгжага4жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗжзгжаКЌгавЛИіБНЛЗЃЌгЩгкАБЛљЁЂєШЛљжаЙВКЌгаЕФ3ИіHдзгЪЧ2жжЛЏбЇЛЗОГВЛЭЌЕФЧтЃЌЙЪСэЭт3ИіHдзгга2жжВЛЭЌЕФЧтЃЌгІДцдкЖдГЦНсЙЙЃЛ
(6)ФЃЗТТЗЯпСїГЬЩшМЦЃЌ![]() ЗЂЩњДпЛЏбѕЛЏЩњГЩ
ЗЂЩњДпЛЏбѕЛЏЩњГЩ![]() ЃЌНјвЛВНбѕЛЏЩњГЩ
ЃЌНјвЛВНбѕЛЏЩњГЩ![]() ЃЌдйгыSOCl2зїгУЩњГЩ
ЃЌдйгыSOCl2зїгУЩњГЩ![]() ЃЌНјвЛВНгыClMgCH(COOC2H5)2ЗДгІЩњГЩ
ЃЌНјвЛВНгыClMgCH(COOC2H5)2ЗДгІЩњГЩ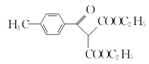 ЃЌзюКѓЫЎНтЩњГЩ
ЃЌзюКѓЫЎНтЩњГЩ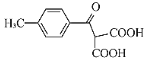 ЁЃ
ЁЃ
(1)GЕФНсЙЙЮЊ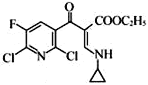 ЃЌЦфжаКЌгаЕФКЌбѕЙйФмЭХгаЃКѕЅЛљЁЂєЪЛљЃЌЙЪД№АИЮЊЃКѕЅЛљЁЂєЪЛљЃЛ
ЃЌЦфжаКЌгаЕФКЌбѕЙйФмЭХгаЃКѕЅЛљЁЂєЪЛљЃЌЙЪД№АИЮЊЃКѕЅЛљЁЂєЪЛљЃЛ
(2)ЖдБШC(![]() )ЁЂD(
)ЁЂD(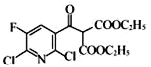 )ЕФНсЙЙЃЌПЩжЊCжаѕЃТШжаТШдзгБЛ-CH(COOC2H5)2ЬцДњЩњГЩDЃЌЪєгкШЁДњЗДгІЃЌЙЪД№АИЮЊЃКШЁДњЗДгІЃЛ
)ЕФНсЙЙЃЌПЩжЊCжаѕЃТШжаТШдзгБЛ-CH(COOC2H5)2ЬцДњЩњГЩDЃЌЪєгкШЁДњЗДгІЃЌЙЪД№АИЮЊЃКШЁДњЗДгІЃЛ
(3)ЛЏКЯЮяXЕФЗжзгЪНЮЊC3H7NЃЌЖдБШF(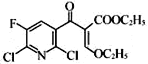 )ЁЂG(
)ЁЂG( )ЕФНсЙЙЃЌFжа-OCH3БЛ
)ЕФНсЙЙЃЌFжа-OCH3БЛ![]() ЬцДњЩњГЩGЃЌЭЌЪБЩњГЩМзДМЃЌдђXНсЙЙМђЪНЮЊЃК
ЬцДњЩњГЩGЃЌЭЌЪБЩњГЩМзДМЃЌдђXНсЙЙМђЪНЮЊЃК![]() ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(4)МзЭщЮЊЫФУцЬхНсЙЙЃЌЕЅМќПЩвда§зЊЃЌдђHC(OC2H5)3жазюЖрга5ИіЬМдзгЙВУцЃЌЙЪД№АИЮЊЃК5ЃЛ
(5)B(![]() )КЭввДМЗДгІЕФВњЮяHЮЊ
)КЭввДМЗДгІЕФВњЮяHЮЊ![]() ЃЌЗДгІЕФЗНГЬЪНЮЊ
ЃЌЗДгІЕФЗНГЬЪНЮЊ![]()
![]()
![]()
![]()
![]() ЃЛHЕФЗжзгЪНЮЊC8H6FCl2NO2ЃЌHЕФвЛжжЭЌЗжвьЙЙЬхТњзуЃКЂёЃЎЪЧвЛжжІС-АБЛљЫсЃЌЫЕУїАБЛљЁЂєШЛљСЌНгЭЌвЛЬМдзгЩЯЃЌЂђЃЎЗжзгжага4жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗжзгжаКЌгавЛИіБНЛЗЃЌгЩгкАБЛљЁЂєШЛљжаЙВКЌгаЕФ3ИіHдзгЪЧ2жжЛЏбЇЛЗОГВЛЭЌЕФЧтЃЌЙЪСэЭт3ИіHдзгга2жжВЛЭЌЕФЧтЃЌгІДцдкЖдГЦНсЙЙЃЌHЕФЭЌЗжвьЙЙЬхНсЙЙМђЪНПЩФмЮЊЃК
ЃЛHЕФЗжзгЪНЮЊC8H6FCl2NO2ЃЌHЕФвЛжжЭЌЗжвьЙЙЬхТњзуЃКЂёЃЎЪЧвЛжжІС-АБЛљЫсЃЌЫЕУїАБЛљЁЂєШЛљСЌНгЭЌвЛЬМдзгЩЯЃЌЂђЃЎЗжзгжага4жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗжзгжаКЌгавЛИіБНЛЗЃЌгЩгкАБЛљЁЂєШЛљжаЙВКЌгаЕФ3ИіHдзгЪЧ2жжЛЏбЇЛЗОГВЛЭЌЕФЧтЃЌЙЪСэЭт3ИіHдзгга2жжВЛЭЌЕФЧтЃЌгІДцдкЖдГЦНсЙЙЃЌHЕФЭЌЗжвьЙЙЬхНсЙЙМђЪНПЩФмЮЊЃК Лђ
Лђ Лђ
Лђ  Лђ
Лђ ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]()
![]()
![]()
![]()
![]() ЃЛ
ЃЛ Лђ
Лђ Лђ
Лђ  Лђ
Лђ ЃЛ
ЃЛ
(6)вд ![]() КЭClMgCH(COOC2H5)2ЮЊдСЯжЦБИ
КЭClMgCH(COOC2H5)2ЮЊдСЯжЦБИ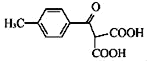 ЁЃФЃЗТТЗЯпСїГЬЩшМЦЃЌ
ЁЃФЃЗТТЗЯпСїГЬЩшМЦЃЌ![]() ЗЂЩњДпЛЏбѕЛЏЩњГЩ
ЗЂЩњДпЛЏбѕЛЏЩњГЩ![]() ЃЌНјвЛВНбѕЛЏЩњГЩ
ЃЌНјвЛВНбѕЛЏЩњГЩ![]() ЃЌдйгыSOCl2зїгУЩњГЩ
ЃЌдйгыSOCl2зїгУЩњГЩ![]() ЃЌНјвЛВНгыClMgCH(COOC2H5)2ЗДгІЩњГЩ
ЃЌНјвЛВНгыClMgCH(COOC2H5)2ЗДгІЩњГЩ ЃЌзюКѓЫЎНтЩњГЩ
ЃЌзюКѓЫЎНтЩњГЩ ЃЌКЯГЩТЗЯпСїГЬЭМЮЊЃК
ЃЌКЯГЩТЗЯпСїГЬЭМЮЊЃК ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаХЯЂвЛЃКИѕЭЌФјЁЂюмЁЂЬњЕШН№ЪєПЩвдЙЙГЩИпЮТКЯН№ЁЂЕчШШКЯН№ЁЂОЋУмКЯН№ЕШЃЌгУгкКНПеЁЂгюКНЁЂЕчЦїМАвЧБэЕШЙЄвЕВПУХЁЃ
аХЯЂЖўЃКТШЛЏИѕѕЃ(CrO2Cl2)ЪЧИѕЕФвЛжжЛЏКЯЮяЃЌГЃЮТЯТИУЛЏКЯЮяЪЧАЕКьЩЋвКЬхЃЌШлЕуЮЊ-96.5ЁцЃЌЗаЕуЮЊ117ЁцЃЌФмКЭБћЭЊ(CH3COCH3)ЁЂЫФТШЛЏЬМЁЂCS2ЕШгаЛњШмМСЛЅШмЁЃ
ЃЈ1ЃЉИѕ(24КХдЊЫи) ЛљЬЌдзгЕФЕчзгХХВМЪНЮЊ___________ЁЃ
ЃЈ2ЃЉCH3COCH3ЗжзгжаКЌга________ИіІаМќЃЌКЌга____________ИіІвМќЁЃ
ЃЈ3ЃЉЙЬЬЌТШЛЏИѕѕЃЪєгк______________ОЇЬхЃЌБћЭЊжаЬМдзгЕФдгЛЏЗНЪНЮЊ______________ЃЌЖўСђЛЏЬМЪєгк______________(ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)ЗжзгЃЌЗжзгжаКЌга____________(ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)МќЁЃ
ЃЈ4ЃЉK[Cr(C2O4)2(H2O)2]вВЪЧИѕЕФвЛжжЛЏКЯЮяЃЌИУЛЏКЯЮяЪєгкРызгЛЏКЯЮяЃЌЦфжаГ§КЌРызгМќЁЂЙВМлМќЭтЃЌЛЙКЌга____________МќЁЃ
ЃЈ5ЃЉН№ЪєИѕЕФОЇАћШчЭМЫљЪОЃЌвЛИіОЇАћжаКЌга_______ИіИѕдзгЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПєЧМзЯуЖЙЫиЪЧвЛжжжЮСЦЕЈНсЪЏЕФвЉЮяЁЃЦфВПЗжКЯГЩЙЄвеШчЯТЃК
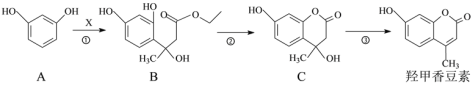
ЃЈ1ЃЉвбжЊ![]() ВЛФмЮШЖЈДцдкЁЃЗДгІЂйжаXЕФЗжзгЪНЮЊC6H10O3ЃЌдђXЕФНсЙЙМђЪНЮЊ________ЁЃ
ВЛФмЮШЖЈДцдкЁЃЗДгІЂйжаXЕФЗжзгЪНЮЊC6H10O3ЃЌдђXЕФНсЙЙМђЪНЮЊ________ЁЃ
ЃЈ2ЃЉЗДгІЂйЁЂЂкЕФЗДгІРраЭЗжБ№ЮЊ________ЁЂ________ЁЃ
ЃЈ3ЃЉЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ________ЁЃ
AЃЎЛЏКЯЮяBКЭCЗжзгИїКЌга1ИіЪжадЬМдзг
BЃЎЛЏКЯЮяCФмЗЂЩњМгГЩЗДгІЁЂШЁДњЗДгІКЭЯћШЅЗДгІ
CЃЎ1 molєЧМзЯуЖЙЫизюЖрПЩгы2 mol NaOHЗДгІ
ЃЈ4ЃЉаДГіТњзуЯТСаЬѕМўЕФЛЏКЯЮяCЕФвЛжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН________ЁЃ
ЂйФмЗЂЩњЫЎНтЗДгІЃЌЧвЫЎНтВњЮяжЎвЛФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЛ
ЂкЗжзгжажЛга2жжВЛЭЌЛЏбЇЛЗОГЕФЧт
ЃЈ5ЃЉЗДгІЂлЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯВЩгУЫсадИпХЈЖШКЌЩщЗЯЫЎ(ЩщжївЊвдбЧЩщЫсH3AsO3аЮЪНДцдк)ЬсШЁжавЉвЉМСAs2O3ЃЎЙЄвеСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
(1)вбжЊЩщдЊЫигыNЭЌвЛжїзхЃЌдзгБШNдзгЖрСНИіЕчзгВуЃЌдђЩщдЊЫиЕФдзгађЪ§ЮЊ___________ЃЌЁАГСЩщЁБжаЫљгУNa2SЕФЕчзгЪНЮЊ_____________ЁЃ
(2)вбжЊЃКAs2S3гыЙ§СПЕФS2-ДцдквдЯТЗДгІЃКAs2S3(s)+3S2-(aq)![]() 2AsS33- ЃЛЁАГСЩщЁБжаFeSO4ЕФзїгУЪЧ___________________________ЁЃ
2AsS33- ЃЛЁАГСЩщЁБжаFeSO4ЕФзїгУЪЧ___________________________ЁЃ
(3)ЁАБКЩеЁБЙ§ГЬжагЩгкЬѕМўЕФдвђЃЌЩњГЩЕФШ§бѕЛЏЖўЬњжаЛьгаЫФбѕЛЏШ§ЬњЃЌжЄУїЫФбѕЛЏШ§ЬњДцдкЕФЪдМСЪЧ_________________________________ЁЃ(аДУћГЦ)
(4)ЁАбѕЛЏЁБЙ§ГЬжаЃЌПЩвдгУЕЅжЪЕтЮЊбѕЛЏМСНјаабѕЛЏЃЌаДГіИУЗДгІЕФРызгЗНГЬЪН__________________ЁЃ
(5)ЕїНкpH=0ЪБЃЌгЩNa3AsO4жЦБИAs2O3ЕФРызгЗНГЬЪНЮЊ_______________ЁЃ
(6)вЛЖЈЬѕМўЯТЃЌгУалЛЦ(As4S4)жЦБИAs2O3ЕФзЊЛЏЙиЯЕШчЭМЫљЪОЁЃШєЗДгІжаЃЌ1molAs4S4(ЦфжаAsдЊЫиЕФЛЏКЯМлЮЊ+2Мл)ВЮМгЗДгІЪБЃЌзЊвЦ28mole-ЃЌдђЮяжЪaЮЊ___________ЁЃ(ЬюЛЏбЇЪН)

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЯѕѕЃТШ(NOClЃЌШлЕуЃК-64.5 ЁцЃЌЗаЕуЃК-5.5 Ёц)ЪЧвЛжжЛЦЩЋЦјЬхЃЌгіЫЎвзЗДгІЃЌЩњГЩвЛжжТШЛЏЮяКЭСНжжбѕЛЏЮяЁЃПЩгУгкКЯГЩЧхНрМСЁЂДЅУНМСМАжаМфЬхЕШЁЃЪЕбщЪвПЩгЩТШЦјгывЛбѕЛЏЕЊдкГЃЮТГЃбЙЯТКЯГЩЁЃ
(1)МззщЕФЭЌбЇФтжЦБИдСЯЦјNOКЭCl2ЃЌжЦБИзАжУШчЯТЭМЫљЪОЃК
ЮЊжЦБИДПОЛИЩдяЕФЦјЬхЃЌЯТБэжаШБЩйЕФвЉЦЗЪЧЃК
зАжУЂё | зАжУЂђ | ||
ЩеЦПжа | ЗжвКТЉЖЗжа | ||
жЦБИДПОЛCl2 | MnO2 | Ђй | Ђк |
жЦБИДПОЛNO | Cu | Ђл | Ђм |
Ђк___________ЃЌЂл___________ЁЃ
(2)ввзщЭЌбЇРћгУМззщжЦЕУЕФNOКЭCl2жЦБИNOClЃЌзАжУШчЭМЫљЪОЃК

ЂйзАжУСЌНгЫГађЮЊaЁњ___________________(АДЦјСїздзѓЯђгвЗНЯђЃЌгУаЁаДзжФИБэЪО)ЁЃ
ЂкзАжУЂїЕФзїгУЮЊ________________ЃЌШєЮоИУзАжУЃЌЂљжаNOClПЩФмЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______________________________ЁЃ
ЂлввзщЭЌбЇШЯЮЊЧтбѕЛЏФЦШмвКжЛФмЮќЪеТШЦјКЭNOClЃЌВЛФмЮќЪеNOЃЌЫљвдзАжУЂјВЛФмгааЇГ§ШЅгаЖОЦјЬхЁЃЮЊНтОіетвЛЮЪЬтЃЌПЩНЋЮВЦјгыФГжжЦјЬхЭЌЪБЭЈШыЧтбѕЛЏФЦШмвКжаЃЌетжжЦјЬхЕФЛЏбЇЪНЪЧ__________ЁЃ
(3)БћзщЭЌбЇВщдФзЪСЯЃЌВщЕУЭѕЫЎЪЧХЈЯѕЫсгыХЈбЮЫсЕФЛьЫсЃЌвЛЖЈЬѕМўЯТЛьЫсПЩЩњГЩбЧЯѕѕЃТШКЭТШЦјЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________ЁЃ
(4)ЖЁзщЭЌбЇгУвдЯТЗНЗЈВтЖЈбЧЯѕѕЃТШ(NOCl)ДПЖШ
ШЁЂљжаЫљЕУвКЬхmgШмгкЫЎЃЌХфжЦГЩ250mLШмвКЃЛШЁГі25.00mLЃЌвдK2CrO4ШмвКЮЊжИЪОМСЃЌгУc mol/LAgNO3 БъзМШмвКЕЮЖЈжСжеЕуЃЌЯћКФБъзМШмвКЕФЬхЛ§ЮЊb mLЁЃ(вбжЊЃКAg2CrO4ЮЊзЉКьЩЋЙЬЬх)
ЂйбЧЯѕѕЃТШ(NOCl)ЕФжЪСПЗжЪ§ЮЊ_________(гУДњЪ§ЪНБэЪОМДПЩ)ЁЃ
ЂкШєЕЮЖЈЧАЃЌЕЮЖЈЙмМтзьгаЦјХнЃЌЕЮЖЈКѓЦјХнЯћЪЇЃЌдђЫљВтбЧЯѕѕЃТШЕФДПЖШ_________(ЦЋИпЁЂЦЋЕЭЁЂЮогАЯь)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщзАжУФмДяЕНЪЕбщФПЕФЪЧ(МаГжвЧЦїЮДЛГі)ЃЈЁЁЁЁЃЉ

A. зАжУЂйгУгкМьбщфхввЭщЯћШЅЩњГЩЕФввЯЉ B. зАжУЂкгУгкЪЏгЭЕФЗжСѓ
C. зАжУЂлгУгкЪЕбщЪвжЦЯѕЛљБН D. зАжУЂмПЩжЄУїЫсадЃКбЮЫсЃОЬМЫсЃОБНЗг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ( )
A.  ДпЛЏМСЛюад
ДпЛЏМСЛюад![]()
B. 
![]()
![]() ,дкКуШнОјШШШнЦїжаЭЖШывЛЖЈСП
,дкКуШнОјШШШнЦїжаЭЖШывЛЖЈСП![]() КЭ
КЭ![]() ЃЌе§ЗДгІЫйТЪЫцЪБМфБфЛЏ
ЃЌе§ЗДгІЫйТЪЫцЪБМфБфЛЏ
C. 
![]()
![]() ЃЌtЪБПЬИФБфФГвЛЬѕМўЃЌдђ
ЃЌtЪБПЬИФБфФГвЛЬѕМўЃЌдђ![]()
D.  ЯђЕШЬхЛ§ЕШpHЕФHClКЭ
ЯђЕШЬхЛ§ЕШpHЕФHClКЭ![]() жаМгШыЕШСПЧвзуСПZnЃЌЗДгІЫйТЪЕФБфЛЏЧщПі
жаМгШыЕШСПЧвзуСПZnЃЌЗДгІЫйТЪЕФБфЛЏЧщПі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЁЂFЁЂG ЪЧЖЬжмЦкдЊЫиЃЌжмЦкБэжа B гы C ЯрСкЃЌC гы E ЭЌжїзхЃЛ A жа L ВуЪЧ K ВуЕФ 2 БЖЃЌB ЕФЕчзгЪ§БШ C ЕФЕчзгЪ§Щй 1 ИіЃЛF дЊЫиЕФдзгдкжмЦкБэжаАыОЖзюаЁЃЛГЃМћЛЏКЯЮя D2C2 гыЫЎЗДгІЩњГЩ C ЕФЦјЬхЕЅжЪЃЌЧвЭъШЋЗДгІКѓЕФШмвКФмЪЙЗгЬЊШмвКБфКьЁЃG ЪЧЕкШ§жмЦкдзгАыОЖзюаЁЕФжїзхдЊЫиЁЃ
(1)A дкдЊЫижмЦкБэжаЕФЮЛжУ_________________ ЁЃ
(2) D2C2 ЕФЕчзгЪНЮЊ________ , Ъєгк________________ЛЏКЯЮяЃЈЬюЁАРызгЁБЛђЁАЙВМлЁБЃЉЁЃ
(3)C гы F дЊЫиПЩаЮГЩ 18 ЕчзгЗжзгЕФЕчзгЪНЮЊ ЁЃ
(4)AЁЂBЁЂC ЕФЧтЛЏЮяЮШЖЈадЫГађЮЊ____________________ЃЈгУЗжзгЪНБэЪОЃЉЃЛ G ЕФвѕРызгЕФЛЙдадБШ E ЕФвѕРызгЕФЛЙдад ___________________________ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
(5)F2C КЭ F2E жаЃЌЗаЕуНЯИпЕФЪЧ________ЃЈЬюЛЏбЇЪНЃЉЃЌЦфжївЊдвђЪЧ _____________ЁЃ
(6)Ю§ЃЈSnЃЉгы A ЭЌжїзхЃЌГЃЮТЯТФмКЭХЈСђЫсЗДгІЃЌЩњГЩ SnЃЈSO4ЃЉ2 КЭДЬМЄадЦјЮЖЦјЬхЃЌ ЗДгІЕФЛЏбЇЗНГЬЪНЮЊ __________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇбЇЯАаЁзщбЇЯАЕчЛЏбЇКѓЃЌЩшМЦСЫвдМзЁЂввСНГизїдЕчГиЕФЪЕбщзАжУЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. КЯЩЯЕчМќКѓЃЌбЮЧХжаЕФбєРызгЯђМзГивЦЖЏ
B. КЯЩЯЕчМќКѓвЛЖЮЪБМфЃЌБћГижаШмвКЕФpHдіДѓ
C. КЯЩЯЕчМќКѓЃЌЖЁГижагаН№ЪєУОЮіГі
D. КЯЩЯЕчМќКѓЃЌМзГижааПЕчМЋЮЊдЕчГиИКМЋ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com