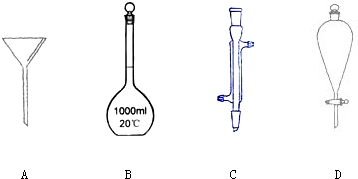
实验室要配制100mL 0.2mol?L-1 Na2CO3溶液.请回答下列问题.
(1)用托盘天平称取无水碳酸钠固体的质量为______ g.
(2)需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(3)下列操作中,可能造成所配制溶液的浓度偏低的是______(填序号).
①碳酸钠固体未充分干燥 ②称量时左盘放砝码 ③转移溶液时有少量滴洒.
【答案】
分析:(1)根据m=cVM计算需要碳酸钠的质量.
(2)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签以及每步操作需要仪器确定反应所需仪器.
(3)分析操作对溶质的物质的量、溶液体积的影响,根据c=

分析操作对所配溶液浓度的影响.
解答:解:(1)实验室配制1mol/L的Na
2CO
3溶液100mL需要Na
2CO
3的质量为:0.1L×0.2mol/L×106g/mol=2.1g.
故答案为:2.1g.
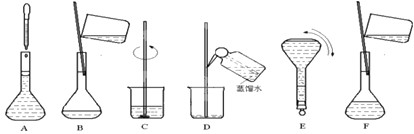
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.
所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管.
所以还需要用的仪器为:托盘天平、药匙、100mL容量瓶.
故答案为:托盘天平、药匙、100mL容量瓶.
(3)①碳酸钠固体未充分干燥,实际称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
②称量时左盘放砝码,由于使用游码,实际称量的碳酸钠的质量为1.9g,称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
③转移溶液时有少量滴洒,移入容量瓶内碳酸钠的物质的量减少,所配溶液的浓度偏低.
故选:①②③.
点评:本题考查了一定物质的量浓度溶液的配制的计算、步骤以及仪器、误差分析等,难度不大,根据c=

理解溶液的配制与误差分析.

 分析操作对所配溶液浓度的影响.
分析操作对所配溶液浓度的影响. 理解溶液的配制与误差分析.
理解溶液的配制与误差分析. 

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案