


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
B、
| ||||||
| C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
| D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
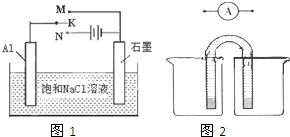 以下是一些物质的熔沸点数据(常压):
以下是一些物质的熔沸点数据(常压):| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、若完全燃烧,1mol雄酮(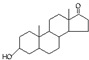 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| C、足量氢氧化钠溶液与碳酸氢钠溶液混合:OH-+HCO3-═H2O+CO32- |
| D、表示氢气燃烧热的化学方程式:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中 c(HA)>c(Cl-)>c(A-)>c(OH-) |
| B、相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大 |
| C、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va:Vb=10:9 |
| D、0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com