
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2<p3 | D. | α1+α2>1 |
分析 甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1molN2、3molH2,丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动.
解答 解:A、甲容器内的平衡与乙容器内平衡是等效平衡,所以平衡时NH3的浓度相等,即c1=c2,丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡正移,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c2,所以c3>2c1,故A错误;
B、甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故C错误;
D、甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,所以转化率α1+α2=1,故D错误;
故选B.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述反应中NO2- 是氧化剂 | |
| B. | 反应过程中溶液的pH增大 | |
| C. | 该反应可以说明氧化性NO3->MnO4- | |
| D. | 上述反应中,1 mol KMnO4可以消耗2.5 mol NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- | |
| B. | pH为1的溶液:Fe2+、K+、ClO-、Cl- | |
| C. | c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、NO3- | |
| D. | 存在较多的H+、SO42-、NO3-的溶液:Al3+、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | 酸溶液 | 温度 | |
| A | Mg | 0.5mol•L-1H2SO4 | 30℃ |
| B | Fe | 1mol•L-1HCl | 20℃ |
| C | Zn | 2mol•L-1HCl | 20℃ |
| D | Mg | 18.4mol•L-1H2SO4 | 30℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Zn | B. | Al、Cu | C. | Al、Fe | D. | Cu、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
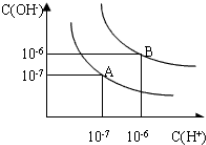
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | 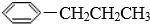 | C. | CH3(CH2)4COOCH3 | D. | CH3(CH2)13SO3Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com