


科目:高中化学 来源:2012-2013学年上海市杨浦区高三上学期学业质量调研化学试卷(解析版) 题型:选择题
向15mL 0.1mol/L Ba(OH)2溶液中,滴加等浓度NH4Al(SO4)2溶液x mL,下列叙述错误的是
A.x=5时,溶液中有Ba2+、OH-、AlO2-,且OH-> AlO2-
B.x=7.5时,溶液中有NH4+、AlO2-,且NH4+=AlO2-
C.x=10时,溶液中有SO42-、NH4+,且H+> OH-
D.x=15时,溶液中有SO42-、NH4+、Al3+,且NH4+> Al3+
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三上学期期末检测化学试卷 题型:选择题
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确
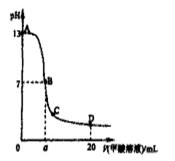
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
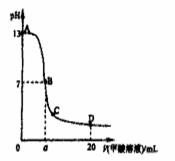
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是:
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com