
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO 的物质的量为
的物质的量为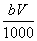 mol
mol
③反应过程中转移的电子为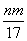 mol
mol
④标准状况下生成NO的体积为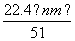 L
L
⑤与合金反应的硝酸的物质的量为 mol
mol
A.5项 B.4项 C.3项 D.2项
解析 本题涉及的反应有Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O;3Mg+8HNO3(稀)===3Mg(NO3)2+2NO↑+4H2O;Al(NO3)3+3NaOH===Al(OH)3↓+3NaNO3;Mg(NO3)2+2NaOH===Mg(OH)2↓+2NaNO3。当合金恰好溶解时,溶液中的NO 与Na+的物质的量相等,n(NO
与Na+的物质的量相等,n(NO )=n(NaOH)=
)=n(NaOH)=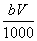 mol,②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子为n(e-)=n(OH-)=
mol,②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子为n(e-)=n(OH-)=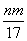 mol,故①③正确。根据电子得失守恒知,标准状况下V(NO)=
mol,故①③正确。根据电子得失守恒知,标准状况下V(NO)=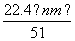 L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即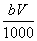 mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即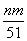 mol,所以,与合金反应的硝酸的物质的量为
mol,所以,与合金反应的硝酸的物质的量为  mol,故⑤正确。
mol,故⑤正确。
答案 A


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
现有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,它们之间关系如下:
Ⅰ.原子半径:A < C < B < E<D
Ⅱ.原子的核外电子层数:B = C = 2A
Ⅲ.B元素的主要化合价:最高正价 +最低负价 = 2
Ⅳ.C是周期表中非金属性最强的元素
V.原子的最外层电子数:B + D = 8
VI.E是同周期中半径最小的原子
请回答:
(1)实验室制取E的单质反应离子方程式为_____________________________________。
(2)只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(3)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
下列可作为比较D和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点 b. 比较最高价氧化物对应的水化物的碱性强弱
c.比较单质与同浓度盐酸反应的剧烈程度 d.. 比较两种元素在化合物中化合价的高低
(4)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式 ______________________ ______________ ________ 。
(5)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,写出检验该盐中所含阳离子的离子方程式 ;
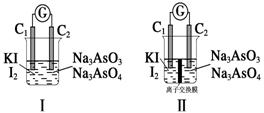 (6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO
(6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO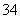 +2I-+2H+
+2I-+2H+ AsO
AsO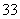 +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
① 甲组电流表指针都不发生偏转的原因是 。
② 乙组添加的是 (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或应用中,不能用胶体知识解释的是( )
A.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
B.用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.Cu(OH)2中加入硫酸:OH-+H+===H2O
B.钠加入水中:Na+2H2O===Na++2OH-+H2↑
C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:


③若转移10 mol e-,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是( )
A.25 ℃时, pH=12的无色溶液:K+、Br-、SO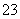 、SiO
、SiO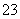
B.与铝粉反应放出氢气的溶液:HCO 、K+、Na+、SO
、K+、Na+、SO
C.使石蕊溶液显红色的溶液:Na+、NH 、Cl-、S2O
、Cl-、S2O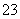
D.25 ℃时,由水电离出来的c(H+)=1×10-13 mol/L的溶液:Ba2+、Cl-、AlO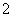 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:

如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
A.该装置将化学能转化为电能
B.电子移动方向由a极到b极
C.可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li++4e-===Fe+2Li2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com