
 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:分析 (1)①根据A、C分别表示反应物总能量的生成物总能量;
②根据参加反应SO2的物质的量之比等于对应的△H之比;
③根据64g SO2气体氧化为SO3气体时放出99kJ的热量来求;
(2)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;将途径Ⅱ的三个化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造出途径I的热化学方程式,据此判断△H1、△H2、△H3、△H4的数学关系式.
解答 解:(1)①因图中A、C分别表示反应物总能量、生成物总能量,故答案为:反应物总能量;生成物总能量;
②因1mol SO2(g)氧化为1mol SO3的△H=-E2kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-2E2kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-2E2kJ•mol-1,故答案为:-2E2;
③因64g 即1molSO2气体氧化为SO3气体时放出99kJ的热量,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,所以SO2氧化为SO3的热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1;
(2)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量.
C(s)+H2O(g)═CO(g)+H2(g)△H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0 ③
2H2(g)+O2 (g)═2H2O(g)△H4<0 ④
由盖斯定律可知,②×2+③+④得2C(s)+2O2 (g)═2CO2(g)△H=2△H2+△H3+△H4.
所以△H1=$\frac{1}{2}$△H=$\frac{1}{2}$(2△H2+△H3+△H4)=△H2+$\frac{1}{2}$(△H3+△H4).
故答案为:等于;△H1=△H2+$\frac{1}{2}$(△H3+△H4).
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,理解盖斯定律是解题的关键,一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,即反应热只与始态和终态有关,而与反应的途径无关,难度不大.


科目:高中化学 来源: 题型:填空题
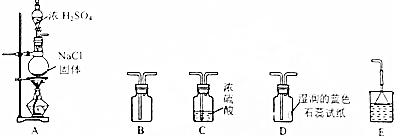
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
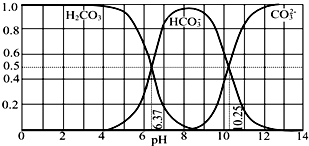
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸反应制CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

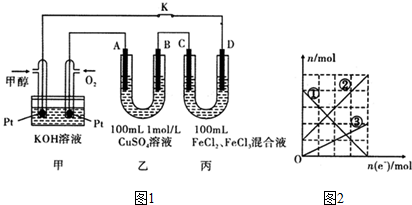
| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com