
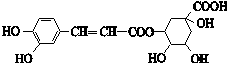 下列有关绿原酸(结构简式如图)的说法不正确的是( )
下列有关绿原酸(结构简式如图)的说法不正确的是( )| A、分子式为C16H18O9 |
| B、1mol绿原酸最多能与8mol NaOH反应 |
| C、1mol绿原酸最多能与4mol H2反应 |
| D、能发生取代反应、消去反应、加成反应和氧化反应 |


科目:高中化学 来源: 题型:
| A、用新制氢氧化铜悬浊液无法鉴别葡萄糖和乙酸 |
| B、乙酸与乙醇可以发生酯化反应,又均可与碳酸氢钠溶液反应 |
| C、硫酸铵、硫酸铜和乙醇均能使蛋白质变性 |
| D、二氯甲烷不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
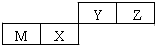
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰熔化时水分子的共价键未发生断裂 |
| B、同族元素的氧化物形成的晶体类型相同 |
| C、分子晶体中,分子间作用力越大,分子越稳定 |
| D、具有高熔沸点的晶体一定是离子晶体或原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
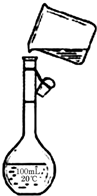 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:
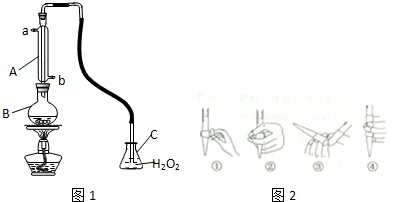
查看答案和解析>>
科目:高中化学 来源: 题型:
 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:| 验序号 | 时间/min 浓度/mol?L-1 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com