
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是

A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.水杨酸可以发生取代、加成、氧化、加聚反应
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,分别对反应C(S)+CO2(g)![]() 2CO(g)(△H>0)进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著变大的是( )
2CO(g)(△H>0)进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析如图装置,完成下面的填空:

(1)该反应的电流方向是_____________。
(2)盐桥中的阴离子向________溶液中移动。
(3)一段时间后,锌片上的现象是_____________,铜片上的现象是______________。
(4)锌极发生_________反应,总反应方程式为_________________。
(5)30min后,1.3g的Zn参加了反应,则转移了_______个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学――选修2:化学与技术]草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含两个结晶水)的工艺流程如下:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 、 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 _____;过滤操作②的滤液是 __和 ,滤渣是________ 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为________;若此离子与[Cu(H2O)4]2+结构相似,则此离子的空间构型为 。
(3)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
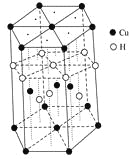
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是 。
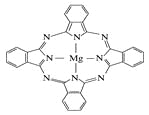
(5) 金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图所示,其中N原子的杂化方式为 ,在如图的方框内请在图中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)X元素在元素周期表中的位置 ,该融雪剂的化学式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为________。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中加热时生成的产物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规
律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有____(填序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称)。
(2)乳酸与金属钠反应的化学方程式为______________________________________________。
(3)乳酸与Na2CO3溶液反应的化学方程式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com