
| A. | 氯水显酸性的主要原因:HClO?H++ClO- | |
| B. | 向氯水中滴加少量NaHCO3溶液:H++HCO3-═CO2↑+H2O | |
| C. | SO2具有漂白性,向氯水中通入少量SO2,溶液的漂白能力降低 | |
| D. | 常温时,氯水中含有的阴离子:Cl-、ClO-、OH- |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,HClO为弱酸,溶液中含有氯气、HClO等分子,含有Cl-、ClO-、H+等离子,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,溶液呈酸性,溶液中氯气、HClO都强氧化性,以此解答该题.
解答 解:A.氯气和水发生Cl2+H2O?HCl+HClO,溶液呈酸性,故A错误;
B.氯水中含有HCl,加入碳酸氢钠,发生H++HCO3-═CO2↑+H2O,故B正确;
C.二氧化硫和氯气发生氧化还原反应生成盐酸和硫酸,溶液的漂白能力降低,故C正确;
D.氯气溶于水发生反应Cl2+H2O?HCl+HClO,含有Cl-、ClO-,且存在水的电离,还存在OH-,故D正确.
故选A.
点评 本题考查物质的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意把握氯气的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
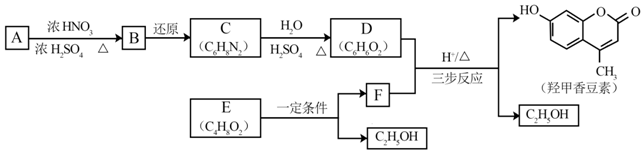
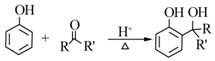
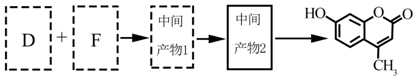
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.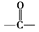 和
和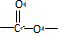 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

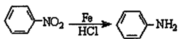 ,-NH2易被强氧化剂氧化
,-NH2易被强氧化剂氧化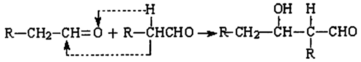
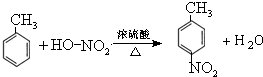 .
.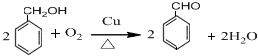 .
.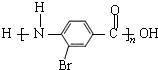 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯甲酸( 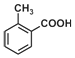 )含有苯环且属于酯类的同分异构体有5种 )含有苯环且属于酯类的同分异构体有5种 | |
| B. | CH3-CH=CH-CH2-CH3中最多有9个原子在同一平面上 | |
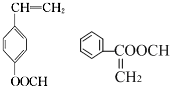
| C. | 有机物 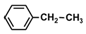 在一定条件下与足量H2加成,所得产物的一氯代物有5种 在一定条件下与足量H2加成,所得产物的一氯代物有5种 | |
| D. | 可以用裂化汽油萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
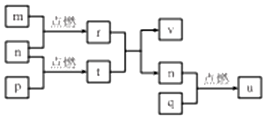 短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )
短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )| A. | 简单离子半径:W>Y>Z>X | |
| B. | W,Y分別与X元素形成的简单化合物的沸点:Y>W | |
| C. | Z2Y和ZX都只存在离子键 | |
| D. | v能抑制水的电离,u的水溶液能促进水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com