
【题目】(1)0.01mol某气体的质量为0.44g,该气体的摩尔质量为_______;在标准状况下,该气体的密度是_______
(2)0.3 mol氨气和0.4 mol二氧化碳的质量________(填“相等”或“不相等”,下同),所含分子数________,所含原子数________.
(3) 质量都是50 g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________,体积最小的是________.
【答案】44g/mol1.96g/L不相等不相等相等CO2NH3CO2
【解析】
(1)气体的摩尔质量M=0.44g![]() 0.01mol=44g/mol;0.01mol气体在标准状况下的体积为0.01mol
0.01mol=44g/mol;0.01mol气体在标准状况下的体积为0.01mol![]() 22.4L/mol=0.224L,该气体在标准状况下的密度为0.44g
22.4L/mol=0.224L,该气体在标准状况下的密度为0.44g![]() 0.224L=1.96g/L。
0.224L=1.96g/L。
(2)0.3molNH3的质量为0.3mol![]() 17g/mol=5.1g,0.4molCO2的质量为0.4mol
17g/mol=5.1g,0.4molCO2的质量为0.4mol![]() 44g/mol=17.6g,0.3molNH3和0.4molCO2的质量不相等;0.3molNH3和0.4molCO2所含分子数之比为3:4,所含分子数不相等;0.3molNH3中所含原子物质的量为0.3mol
44g/mol=17.6g,0.3molNH3和0.4molCO2的质量不相等;0.3molNH3和0.4molCO2所含分子数之比为3:4,所含分子数不相等;0.3molNH3中所含原子物质的量为0.3mol![]() 4=1.2mol,0.4molCO2中所含原子物质的量为0.4mol
4=1.2mol,0.4molCO2中所含原子物质的量为0.4mol![]() 3=1.2mol,0.3molNH3和0.4molCO2中所含原子数相等。
3=1.2mol,0.3molNH3和0.4molCO2中所含原子数相等。
(3)HCl、NH3、CO2、O2的摩尔质量由大到小的顺序为M(CO2)>M(HCl)>M(O2)>M(NH3),质量都是50g的HCl、NH3、CO2、O2物质的量由大到小的顺序为n(NH3)>n(O2)>n(HCl)>n(CO2),则所含分子数最少的是CO2;在相同温度和压强下,气体体积之比等于气体分子物质的量之比,体积最大的是NH3;体积最小的是CO2。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的分类或性质描述不正确的是( )
A.NaClO是盐,具有强氧化性
B.氯气能使湿润的红色布条褪色,是因为氯气具有漂白性
C.氯气能使湿润的红色布条褪色,是因为HClO具有漂白性
D.干燥的氯气不具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:

①中涉及的主要反应有:
主反应:4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是___________。
(2)③中调节pH至4.7,目的是____________________________。
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:___________________________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2molL﹣1H2SO4和足量NaI(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200molL﹣1Na2S2O3标准溶液滴定。
(已知:I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:__________________________;
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度为(设整个过程中其它杂质不参与反应)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于F、Cl、Br、I的说法不正确的是( )
A.原子核外电子层数逐渐增多
B.被其他卤素单质从其卤化物中置换出来的可能性逐渐增大
C.单质的颜色逐渐加深
D.氢化物稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸和强碱的稀溶液中和时,中和热为57.3kJ,试计算:
(1)浓度为0.1mol·L-1的NaOH溶液200mL,与足量酸反应时,能放出多少千焦的热量_____?
(2)浓度为5%的H2SO4溶液980g,与足量的NaOH溶液反应,能放出多少热量______ ?
(3)用浓度为0.2mol·L-1的HNO3 100mL,与足量的NaOH溶液反应,能放出多少热量_____ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Cu(OH)2与稀硝酸反应:H++OH-=H2O
B. 铜片与浓硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C. 铁与稀硝酸反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 浓烧碱溶液中加入铝片:2Al + 4OH-= 2AlO2- + 2 H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L一氯甲烷中含极性共价键数目为4NA
B. 常温下,46g NO2、N2O4组成的混合气体中所含有的分子数为NA
C. 36g3H2中含有的中子数目为12NA
D. 2.24 L(标准状况)O2与足量钠反应时,转移电子数目不可能为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如图。下列说法正确的是
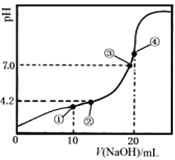
A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com