
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是_______________(填“氧化剂”或“还原剂”)。
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的化学方程式(不必配平):_________________________________。该反应中的氧化产物是________________。
(2)下图中,P为一个可以自由滑动的活塞。关闭K,分别向A、B两容器中各充入2 mol X和2 mol Y,在相同温度和有催化剂存在的条件下,两容器中各自发生如下反应:

2X(g)+Y(g)![]() 2Z(g)+2W(g)
2Z(g)+2W(g)
已知:起始时,VA=
①A、B两容器达到平衡的时间tA________________tB(填“大于”“小于”或“等于”);
②计算该温度下反应的化学平衡常数K=___________;
③当A、B分别达到平衡时,B容器中Y的转化率为____________,两容器中W的体积分数关系为A____________B(填“大于”“小于”或“等于”);
④打开K,一段时间后反应再次达到平衡,则此时B的体积为____________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省六校教育研究会高三测试理综化学试卷(解析版) 题型:填空题
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)
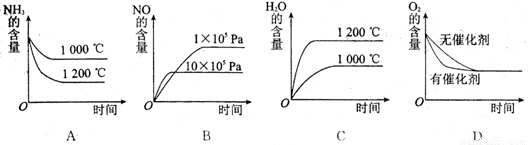
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
|
浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
|
起 始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
x |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸 吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
查看答案和解析>>
科目:高中化学 来源:2014届云南省高二下学期期末考试化学卷(解析版) 题型:填空题
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
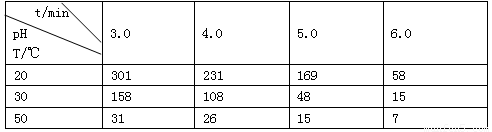
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)

①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
|
时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
|
平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g)  CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为 ,此时的温度 250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: 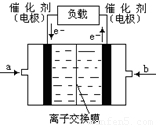
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com