
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为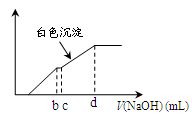
A.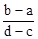 | B.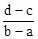 |
C.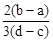 | D. |
D
解析试题分析:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0-amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,令氢氧化钠浓度为xmol/L,Fe3+完全沉淀消耗氢氧化钠为(b-a)mL,结合Fe3++3OH-═Fe(OH)3↓可知,溶液中n(Fe3+)=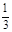 ×(b-a)×10-3Lxmol/L,
×(b-a)×10-3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d-c)mL,结合Mg2++2OH-═Mg(OH)2↓可知,溶液中n(Mg2+)=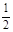 ×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)=
×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)=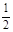 ×(d-c)×10-3Lxmol/L:
×(d-c)×10-3Lxmol/L: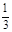 ×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
考点:本题以图象形式考查混合物的有关计算,题目难度较大,清楚各段发生的反应是解题关键,导致出错的原因是学生不能考虑铁离子酸性较强的溶液中存在,不能分析各段发生反应。


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.相同物质的量的O2和O3,体积相同 |
| B.离子化合物一定含有离子键,可能含有共价键 |
| C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA为阿伏加德罗常数,下列叙述正确的是
| A.10 g H18 2O含有的中子数为5NA |
| B.1 mol羟基(-OH)含有的电子数为10NA |
| C.1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D.标准状况下,11.2L己烷含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中指定粒子数目一定大于NA的是
| A.常温常压下,11.2LN2和NO的混合气体所含的原子数 |
| B.1molCl2参加化学反应获得的电子数 |
| C.1L1mol/LCH3COOH溶液中所含分子总数 |
| D.28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某结晶水合物的化学式为R?nH2O,其相对分子质量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液。下列表达式正确的是
A.饱和溶液物质的量浓度为: 1000 a(M -18n) mol/L 1000 a(M -18n) mol/L |
B.饱和溶液溶质的质量分数为: |
C.25℃时R的溶解度为: g/100 g H2O g/100 g H2O |
D.饱和溶液的密度为: g/mL g/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和○代表不同元素的原子。关于此反应说法错误的是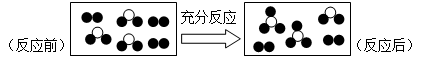
| A.一定属于可逆反应 | B.一定属于化合反应 |
| C.一定属于氧化还原反应 | D.一定属于放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是(设NA表示阿伏加德罗常数的值)
| A.可用盐析法分离NaCl溶液和淀粉胶体 |
| B.天然油脂的分子中含有酯基,属于酯类 |
| C.T℃时,1 L pH=6的纯水中,含有的OH-数目为l×10-6NA |
| D.12.0 gNaHSO4固体中含有的阳离子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关化学用语使用正确的是 ( )
A.HClO的电子式: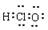 |
B.具有16个质子、16个中子和18个电子的微粒是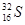 |
C.邻羟基苯甲酸的结构简式: |
D.乙烯的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com