
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
分析 A、如果右侧是镀铜废液,则M(一种金属)与硫酸铜会发生自发的氧化还原反应,则不能构成原电池;
B、右侧是原电池的负极发生氧化反应,电极反应式为:HCH0-2e-+0H-=HC0O-+2H+;
C、若将质子交换膜换成阴离子交换膜,放电过程中,左侧是原电池的正极,OH-应向负极迁移;
D、红色物质是铜离子放电得到单质铜,蓝色絮状物.
解答 解:A、如果右侧是镀铜废液,则M(一种金属)与硫酸铜会发生自发的氧化还原反应,则不能构成原电池,所以反应之前,应将含OH-的HCHO溶液加人到装置的右侧,故A错误;
B、右侧是原电池的负极发生氧化反应,电极反应式为HCH0-2e-+0H-=HC0O-+2H+,故B错误;
C、若将质子交换膜换成阴离子交换膜,放电过程中,左侧是原电池的正极,OH-应向负极迁移,而不是向左侧,故C错误;
D、红色物质是铜离子放电得到单质铜,蓝色絮状物,所以移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现,故D正确;
故选D.
点评 本题考查原电池的反应原理,学生要清楚构成原电池的原理和离子的移动方向以及电极反应式的书写,比较容易.


科目:高中化学 来源: 题型:解答题
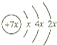 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
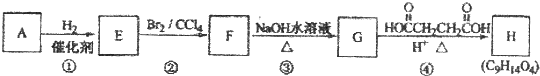
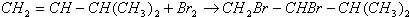 ;
;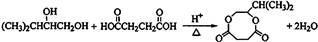 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法可鉴别羊毛制品相涤纶制品 | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 严禁乱弃废电池,防止重金属污染土壤和水源 | |
| D. | 某些食品的包装袋内常放人一小包生石灰作干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com