
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
分析 A.发生2HCl+2Na═2NaCl+H2↑,Na作还原剂,HCl作氧化剂;
B.发生2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3没有化合价变化;
C.发生I2+2NaClO3═2NaIO3+Cl2,I2作还原剂,NaClO3作氧化剂;
D.发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,一半HCl作还原剂.
解答 解:A.发生2HCl+2Na═2NaCl+H2↑,Na作还原剂,HCl作氧化剂,则氧化剂和还原剂的物质的量之比为1:1,故A不选;
B.发生2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3没有化合价变化,不属于氧化还原反应,故B不选;
C.发生I2+2NaClO3═2NaIO3+Cl2,I2作还原剂,NaClO3作氧化剂,则氧化剂和还原剂的物质的量之比为2:1,故C不选;
D.发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,一半HCl作还原剂,MnO2为氧化剂,则氧化剂和还原剂的物质的量之比为1:2,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意HCl(浓)的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 步骤(1)中每析出12.8g S沉淀共转移0.4mol电子 | |
| B. | 步骤(1)中ZnS的还原性大于MnSO4的还原性 | |
| C. | 电解时MnO2在阳极处产生 | |
| D. | 硫酸在生产中可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ. | t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 光照一段时间氯水,溶液的pH值增大 | |
| C. | 加入少量固体AgNO3,溶液的pH值减小 | |
| D. | 加入少量水,水的电离平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
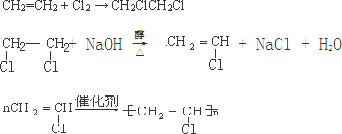 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com